Żarłacz czarnopłetwy
| Carcharhinus limbatus[1] | |||
| (Müller & Henle, 1839) | |||
 | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Podgromada | |||
| Rząd | |||
| Rodzina | |||
| Rodzaj | |||
| Gatunek | żarłacz czarnopłetwy | ||
| Synonimy | |||
| |||
| Kategoria zagrożenia (CKGZ)[9] | |||
 | |||
| Zasięg występowania | |||
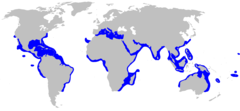 Zasięg występowania żarłacza czarnopłetwego | |||
Żarłacz czarnopłetwy[10] (Carcharhinus limbatus) – gatunek dużej drapieżnej ryby chrzęstoszkieletowej z rodziny żarłaczowatych (Carcharhinidae). Występuje w tropikalnych wodach wszystkich oceanów. Najczęściej spotykany w pobliżu mulistych zatok, lagun, raf koralowych, estuariów oraz zalewisk namorzynowych. Zamieszkuje wody o głębokości zwykle nie przekraczającej 30 metrów, wzdłuż górnych krawędzi szelfów kontynentalnych, choć potrafi zejść na większą głębokość. Posiada wrzecionowaty korpus oraz wydłużoną, wąską głowę, o ostro zakończonym pysku ze stosunkowo dużym otworem gębowym. Cechą charakterystyczną tego gatunku są zęby o stosunkowo wąskich trzonach oraz ciemniejsze końcówki płetw (z wyjątkiem płetwy odbytowej). Osiąga maksymalnie 2,6 m przy wadze niemal 123 kg, choć zwykle dorosłe osobniki mierzą około 1,5 m długości.
Podobnie jak inne żarłaczowate, jest żyworodny. Kopulacja odbywa się za pomocną pterygopodium, narządu płciowego samca. Samica rodzi od 1 do 10 młodych (zwykle 4-7) co dwa lata. Ciąża trwa 10-12 miesięcy. Żarłacze czarnopłetwe mogą rozmnażać się za pomocą partenogenezy oraz krzyżować się z C. tilstoni. Dieta żarłacza czarnopłetwego składa się głównie z wszelkiego rodzaju ryb kostnoszkieletowych, w mniejszym stopniu ryb chrzęstnoszkieletowych, głowonogów i skorupiaków. Rekin ten pływa najczęściej w dużych skupiskach (z wyjątkiem ciężarnych samic). Zwykle nieśmiałe i płochliwe, lecz w obecności pokarmu mogą stać się agresywne, co w połączeniu z ich wielkością oraz szybkością może stanowić realne zagrożenie dla ludzi. Gatunek ten odpowiedzialny jest za kilkadziesiąt ataków na ludzi, w tym jeden śmiertelny.
Poławia się go na całym świecie w celach handlowych. Cenione są zarówno jego płetwy i mięso, ale również skóra, olej z wątroby i szczęki. Z uwagi na dużą siłę i długą walkę jest to jeden z bardziej popularnych wśród wędkarzy rekinów. Międzynarodowa Unia Ochrony Przyrody uznała, że rekin ten jest gatunkiem narażonym na wyginięcie, oświadczając również, że stosunkowo powolne tempo reprodukcji czyni go podatnym na przełowienie. Jedynie Australia i Stany Zjednoczone regulują połowy tego gatunku, lecz na żadnym obszarze nie jest on objęty ochroną.
Taksonomia i etymologia
Rekin ten został opisany w 1839 roku przez dwóch niemieckich przyrodników – Johannesa Petera Müllera i Friedricha Gustava Jakoba Henle – w pracy pt. "Systematische Beschreibung der Plagiostomen" jako Carcharias (Prionodon) limbatus[11]. Okazy typowe, wyłowione w wodach archipelagu Wysp Nawietrznych u wybrzeży Martyniki, zaginęły w późniejszych latach[12][13]. Obecnie uznaje się, że podrodzaj Carcharias (Prionodon) jest synonimem rodzaju Carcharhinus Blainville, 1816, pomimo formalnych niedostatków opisu rodzaju Carcharhinus dokonanego przez Blainville'a[14][15]. Nazwa rodzajowa (z greki: κάρχαρος = karcharos – zaostrzony, ῥίς, ῥινός = rhinos – nos) odnosi się do kształtu głowy[16]. Pochodzący z łaciny epitet gatunkowy limbatus oznacza "obrzeżony, obramowany" i – podobnie jak polska nazwa – nawiązuje do charakterystycznych ciemniejszych od reszty ciała końcówek płetw[17].
Filogenetyka i ewolucja
W pracy dotyczącej badań filogenetycznych żarłaczowatych na podstawie cech morfologicznych, opublikowanej w 1982 roku, Jack Garrick uznał na podstawie kształtu zębów, stosunków wielkości oraz rozmieszczenia płetw, że żarłacz czarnopłetwy tworzy klad z Carcharhinus brevipinna i C. amblyrhynchoides[18]. W 1988 roku Leonard Compagno, opierając się na fenetycznych badaniach, potwierdził to założenie, dołączając do tego kladu również C. leiodon i C. isodon[19]. Analiza filogenetyczna na podstawie danych allozymowych, opublikowanych przez Gavina Naylora w 1992 roku, wskazuje, że gatunek ten jest taksonem siostrzanym do kladu, który tworzą C. porosus i C. sealei[20]. Mine Dosay-Abkulut's w 2008 roku dzięki analizie rybosomalnego DNA wskazał, że C. limbatus jest najbliżej spokrewniony z C. acronotus. Założenie to uznał jednak za niepewne i wymagające dalszych badań[21]. Z badań molekularnych czterech loci mitochondrialnych (COI, NADH-2, CytB, 16S RNA) oraz jednego locus jądrowego (Rag-1) wynika, że C. limbatus tworzy klad z C. amblyrhynchoides, siostrzany dla C. tilstoni i C. fitzroyensis[22].
Wcześniejsze badania Keeney'a i innych z 2006 roku dotyczące mitochondrialnego DNA ujawniły dwie odrębne linie rozwojowe w obrębie tego gatunku: jedną obejmującą osobniki zamieszkujące zachodni Atlantyk, drugą obejmującą populacje wschodniego Atlantyku i Indopacyfiku. Z danych tych wynika, że populacja indopacyficzna pochodzi od osobników zamieszkujących wschodni Atlantyk, podczas gdy populacja zachodnioatlantyczna została odizolowana od reszty przez rozszerzający się Atlantyk oraz powstanie Przesmyku Panamskiego. Żarłacze czarnopłetwe z tych dwóch regionów różnią się pod względem morfologii, ubarwienia oraz szczegółów cyklu życiowego[23]. Analiza mitochondrialnego locus NADH-2 przeprowadzona w 2012 u 98 osobników C. limbatus potwierdza to założenie. Ponadto uznaje, że różnice powstałe na skutek izolacji obu populacji są wystarczająco wyraźne do wyodrębnienia dwóch gatunków: C. limbatus zamieszkującego obszar zachodniego Atlantyku oraz C. cf. limbatus występującego w wodach wschodniego Atlantyku oraz Indopacyfiku[24]. Co więcej – wyniki te wskazują na bliższe pokrewieństwo C. limbatus z C. tilstoni oraz C. amblyrhynchoides niż C. cf. limbatus[25]. Naylor i inni zasugerowali wskrzeszenie jednego z synonimów żarłacza czarnopłetwego – C. pleurotaenia (Bleeker, 1852) – w przypadku potwierdzenia ważności taksonu C. cf. limbatus[24]. Skamieniałe zęby należące do tego gatunku, znalezione na obszarze stanów Delaware i Floryda, datowane są na wczesny miocen (23-16 Ma)[26][27].
Występowanie i środowisko
Żarłacz czarnopłetwy zamieszkuje tropikalne i subtropikalne strefy przybrzeżne Oceanu Spokojnego, Atlantyckiego i Indyjskiego. Na zachodzie Atlantyku spotykany od Massachusetts po południowe krańce Brazylii, w tym w Zatoce Meksykańskiej oraz Morzu Karaibskim. Na wschodzie Atlantyku występuje w Morzu Śródziemnym, w wodach wokół Madery, Wysp Kanaryjskich oraz u wybrzeży Liberii, Wybrzeża Kości Słoniowej, Ghany, Togo, Beninu, Nigerii, Kamerunu, Gwinei Równikowej, Gabonu, Konga, Angoli i Demokratycznej Republiki Konga. Na obszarze Oceanu Indyjskiego zamieszkuje wody przybrzeżne południowej i zachodniej Afryki oraz Madagaskaru na zachodzie, wody od Półwyspu Arabskiego po wschodnie wybrzeża subkontynentu indyjskiego na północy oraz wybrzeża południowo-wschodniej Azji oraz północno-zachodnie krańce Australii na wschodzie. Na zachodzie Pacyfiku spotykany jest od południowych wybrzeży Chin po północno-wschodnie wybrzeża Australii, w tym na Filipinach i w Indonezji. Na wschodzie zamieszkuje wody od Zatoki Kalifornijskiej na północy po północnej krańce Peru na południu. Spotykany również w wodach wokół wielu pacyficznych wysp, w tym Nowej Kaledonii, Tahiti, Hawajów, Galapagos, Markizów i Archipelagu Revillagigedo[12].
Rekin ten przebywa zwykle w wodach o głębokości nie przekraczającej 30 m (choć może schodzić nawet na głębokość 64 metrów), w pobliżu górnych półek kontynentalnych i wyspowych szelfów[16]. Preferuje zatoki o mulistym dnie, laguny oraz rafy koralowe. Toleruje wody o niskim zasoleniu, wpływając niekiedy do estuariów czy zalewisk namorzynowych. Choć pojedyncze osobniki spotyka się niekiedy z dala od brzegu, nie jest to jednak gatunek zamieszkujący otwarte wody oceaniczne[12]. Udokumentowano sezonowe migracje żarłacza czarnopłetwego u wybrzeży Stanów Zjednoczonych – w lecie dorosłe osobniki przemieszczają się na północ w okolice wybrzeży Północnej Karoliny, zaś zimą wracają do cieplejszych wód w pobliżu Florydy[28].
Cechy morfologiczne
Rekin ten posiada wrzecionowaty korpus oraz wydłużoną wąską głowę o ostro zakończonym pysku ze stosunkowo dużym, U-kształtnym otworem gębowym. W szczękach mieści się kilka rzędów zębów – pierwszy z nich ułożony jest pionowo, a każdy kolejny coraz bardziej pochylony ku tyłowi. W razie utraty któregoś z zębów na jego miejsce przesuwa się następny z kolejnego rzędu[12][13]. Żarłacz czarnopłetwy posiada zęby o charakterystycznych wąskich trzonach (zarówno w przypadku górnych, jak i dolnych zębów), podobne do tych u C. isodon czy C. brevipinna. Górne zęby są masywniejsze od dolnych, a ich trzon jest szerszy w stosunku do podstawy. Krawędzie są ostre i gładkie, z wyjątkiem górnych skrajnych zębów, u których krawędzie w miejscach zakrzywienia trzonu stają się wyraźniej piłkowane. Zarówno górne, jak i dolne zęby są nieco zakrzywione na boki (w kierunku spojenia szczęk). W szczęce mieszczą się 32 zęby (w układzie 15:2:15), w żuchwie 31 (15:1:15)[29]. Niewielkie nozdrza osadzone są po bokach spodniej strony pyska – bliżej otworu gębowego, niż szczytu pyska – posiadają małe trójkątne fałdy skórne. Stosunkowo duże, okrągłe oczy wyposażone są w fałdy półksiężycowate spojówek (ochraniające migotkę). Źrenice są zwężone i wydłużone wertykalnie. Za nimi znajdują się niewielkie owalne tryskawki. Rekin ten posiada pięć niedużych równych szczelin skrzelowych. Na spodzie pyska rekin posiada liczne elektroreceptory zwane ampułkami Lorenziniego[12][13].
Tępo zakończona pierwsza trójkątna płetwa grzbietowa ma wolną dalszą końcówkę. Kształtem przypomina łagodnie wygięty ku tyłowi sierp. Mniejsza druga płetwa grzbietowa ma romboidalny kształt i szeroką podstawę. Umiejscowiona jest tuż nad płetwą odbytową. Pomiędzy płetwami grzbietowymi widoczny wyraźny międzygrzbietowy łuk. Płetwy piersiowe są stosunkowo małe i wąskie, z nieznacznie zagiętą dystalną krawędzią. Ulokowane są tuż za ostatnią parą szczelin skrzelowych. Małe płetwy brzuszne, podobnie jak pierwsza druga grzbietowa, mają romboidalny kształt. U samca z wewnętrznej, tylnej części płetw brzusznych wykształcił się narząd kopulacyjny zwany pterygopodium. Płetwa odbytowa jest podobnej wielkości co druga płetwa grzbietowa, lecz nieco mniejsza od płetw brzusznych. Posiada prostą proksymalną krawędź, w przeciwieństwie do dystalnej, która jest mocno wygięta. Na końcu ogona mieści się heterocerkiczna płetwa ogonowa. Na końcu jej górnego płata – kilkukrotnie dłuższego od dolnego – mieści się duży, szeroki trójkątny fałd skórny, poprzedzony wyraźnym wcięciem[12][13].
Skórę rekina pokrywają romboidalne połyskujące łuski plakoidalne. W zależności od umiejscowienia na ciele przybierają różny kształt, wielkość czy gęstość rozmieszczenia. Łuski znajdujące się na bokach i grzbiecie ciała są węższe i bardziej zakrzywione, przez co gęściej rozłożone od łusek pokrywających przednią krawędź płetw piersiowych. Te drugie są niższe, szersze i znacznie masywniejsze. Poza kształtem różnią się również fakturą zewnętrznych powierzchni. Łuski z pyska, przedniej części płetw oraz boków ciała są płaskie lub lekko falowane, w przeciwieństwie do tych pokrywających dystalne krawędzie płetw oraz ogon zwierzęcia, które są mocno rowkowane. Wpływa to w dużej mierze na opływowość i prędkość pływania[30]. Grzbiet rekina przybiera różną barwę, od błękitu poprzez jasnoszary, ciemnoszary, oliwkowy lub niekiedy nawet brąz. Spód i boki są nieco jaśniejsze, barwy białej lub srebrnej[13]. Możliwe jest występowanie pełnego lub częściowego albinizmu[31]. Końcówki płetw grzbietowych, brzusznych i ogonowej są ciemniejsze od reszty ciała. Cecha ta widoczna jest zwłaszcza u młodych osobników, u starszych zanika z wiekiem. W przeciwieństwie do podobnego C. tilstoni rekin ten nie posiada plamki na końcu płetw brzusznych[13]. Inną cechą odróżniającą te gatunki jest liczba żeber (174–182 u C. tilstoni i 182–203 u C. limbatus)[32]. Żarłacze czarnopłetwe mogą mierzyć nawet 2,6 m, jednakże zwykle osiągają około 1,5 metra długości. Najcięższy złowiony osobnik ważył niemal 123 kg[16]. Samice są zwykle nieco większe od samców[32].
Zachowanie
Żarłacz czarnopłetwy jest bardzo szybkim i energicznym drapieżnikiem, występującym zwykle w dużych grupach[17]. Dorosłe samce przebywają razem z nieciężarnymi samicami oraz starszymi podrostkami. Młode – w tym nowo narodzone – osobniki tworzą duże skupiska, dzięki którym są lepiej chronione przed atakami drapieżników[12]. Za dnia skupiają się w dużych grupach, nocą zaś rozpraszają się w poszukiwaniu pokarmu[33]. Dorosłe osobniki nie mają naturalnych wrogów[13]. Z uwagi na rozmiary i nieśmiałe usposobienie żarłacze czarnopłetwe często przegrywają w konkurowaniu o pokarm z żarłaczami galapagoskimi (C. galapagensis) oraz żarłaczami srebrnopłetwymi (C. albimarginatus)[12]. W chwili zagrożenia lub zaniepokojenia rekin ten wykazuje specyficzne zachowanie, przejawiające się mocnym wyginaniem grzbietu, obniżaniem płetw piersiowych, otwieraniem otworu gębowego oraz przesadnym pływaniem z boku na bok[34].
Podobnie jak C. brevipinna, również żarłacz czarnopłetwy znany jest z wyskoków ponad powierzchnię wody, w trakcie których potrafi odwrócić się kilkukrotnie wokół własnej osi. Niektóre z tych wyskoków są efektem końcowym pionowych ataków na grupy małych pływających przy powierzchni ryb[17]. Obserwacje na Bahamach sugerują, że zachowanie te służy również pozbyciu się przyczepionych do ciała podnawkowatych, które podrażniają skórę rekina oraz zmniejszają jego opływowość i zwinność[35][36]. Podczas takich wyskoków rekin może osiągnąć prędkość około 6,3 m/s[37].
Pasożytnictwo
Wśród pasożytów wewnętrznych tego gatunku wyróżnia się tasiemce z rzędów Tetraphyllidea (Anthobothrium, Cathetocephalus, Doliobothrium, Paraorygmatobothrium i Phoreiobothrium)[38][39], Trypanorhyncha (Callitetrarhynchus, Dasyrhynchus, Floriceps, Heteronybelinia, Nybelinia, Otobothrium, Poecilancistrium, Proemotobothrium, Pseudogrillotia, Pterobothrium i Tentacularia)[40][41] i Lecanicephalidea (Tylocephalum)[42]. Larwy tasiemców bytują się w skorupiakach, rybach kostnoszkieletowych i głowonogach. Po zjedzeniu ich przez rekina tasiemiec rozwija się w formę dorosłą[40]. Tetraphyllidea zagnieżdżają się w zastawce spiralnej serca[43], podczas gdy Trypanorhyncha i Lecanicephalidea żyją w górnym fragmencie jelita[40]. Na skórze żarłacza czarnopłetwego spotyka się myksosporidie z gatunku Kudoa carcharhini[44], przywry monogeniczne (Dermophthirius, Dionchus i Erpocotyle)[45], przywry digenetyczne (Paramonilicaecum, Selachohemecus i Staphylorchis)[46], widłonogi (Alebion, Dinemoura, Eudactylina, Kroyeria, Lepeophtheirus, Nemesis, Nesippus, Pandarus, Paralebion i Perissopus)[47][48], równonogi (Gnathia)[49] i pijawki (Stibarobdella)[50]. Żarłacz czarnopłetwy widywany jest często z przyczepionymi do boku podnawkowatymi z rodzaju Echeneis (najczęściej Echeneis naucrates). Ryby te dzięki przekształconej w owalną przyssawkę płetwie grzbietowej podróżują wraz z rekinem odżywiając się resztkami jego pożywienia[35].
Odżywianie
Ryby stanowią 90% diety żarłacza czarnopłetwego[51]. Rekin ten poluje na wiele różnych gatunków, w tym: sardynki, śledziowate, sardelowate, elopsy, ariusowate, fistulki, flądrowate, wiciakowate, mugilowate, makrelowate, ostrobokowate, strzępielowate, żuchwikowate, prażmowate, letrowate, luszczowate, żuwakowate, pielęgnicowate, rogatnicowate, kosterowate i najeżkowate oraz ryby z rodziny Gerreidae. Ofiarami padają również płaszczki i raje, oraz małe gatunki rekinów z rodzajów Mustelus i Rhizoprionodon, rzadziej skorupiaki, głowonogi i kręgowce[12][52]. W wodach Zatoki Meksykańskiej najczęstszą zdobyczą jest menhaden wielkołuski (Brevoortia patronus) oraz mikun (Micropogonias undulatus)[51], a u wybrzeży Południowej Afryki, ostrobokowate i mniejsze śledziowate[52]. Młode rekiny odżywiają się odpowiednio mniejszymi rybami, takimi jak Eucinostomus argenteus, Opisthonema oglinum czy Gerres cinereus [53]. Żarłacze te polują zwykle wczesnym rankiem lub późnym popołudniem[51]. Przebywanie w dużych grupach oraz nadpobudliwość w obecności pokarmu sprzyjają występowaniu u żarłaczy czarnopłetwych szału jedzenia, czyli zachowania polegającego na rywalizacji pomiędzy poszczególnymi osobnikami i gwałtownym przyjmowaniu dużych ilości pokarmu w krótkim czasie. Sytuacje takie mają miejsce na przykład w sytuacji pozbywania się za burtę dużych ilości resztek przez statki rybackie[12].
Cykl życiowy
Podobnie jak inne żarłaczowate jest żyworodny. Samice rodzą od 1 do 10 młodych (zwykle 4-7) co dwa lata. Poród ma miejsce w płytkich przybrzeżnych wodach, które obfitują w pokarm i zapewniają większe bezpieczeństwo samicom i młodym[12]. Wśród takich miejsc można wymienić Pine Island Sound, zatokę Terra Ceia oraz Yankeetown u wybrzeży Florydy, zatokę Bulls Bay u wybrzeży Karoliny Południowej oraz Pontal do Paraná u wybrzeży południowej Brazylii[54][55]. Żarłacz czarnopłetwy jest gatunkiem filopatrycznym, podrośnięte i dorosłe osobniki są bardzo mobilne i w ciągu roku pokonują duże dystanse, lecz powracają w celu rozmnożenia na te same obszary, na których same przyszły na świat. W rezultacie powoduje to powstanie wielu genetycznie odrębnych populacji o nakładających się na siebie obszarach występowania[54][56].
Okres godowy trwa od wiosny do wczesnego lata. Młode rodzą się mniej więcej w tym samym czasie w następnym roku, po trwającej 10-12 miesięcy ciąży[12]. Zapłodnienie odbywa się za pomocą pterygopodium, narządu wykształconego z dystalnych fragmentów płetw brzusznych samców. Samice posiadają jeden funkcjonalny jajnik oraz dwie macice. Każda macica podzielona jest na odizolowane segmenty, osobne dla każdego z embrionów[57]. Embriony w ciele matki zużywają zapasy żółtka z pęcherzyka żółtkowego. Po 10-11 tygodniach, czyli osiągnięciu 18-19 cm długości, pęcherzyk żółtkowy łączy się ze ścianą macicy, tworząc tzw. łożysko żółtkowe, dzięki któremu dostarczane jest pożywienie z organizmu matki, aż do momentu porodu[28]. Młode w trakcie narodzin mierzą 55-60 cm u wschodnich wybrzeży Stanów Zjednoczonych oraz 61-65 cm u wybrzeży Północnej Afryki[28][57]. Umieralność wśród młodych podczas pierwszych 15 miesięcy życia wynosi od 61 do 91%, przy czym główną przyczyną zgonów jest drapieżnictwo oraz głód[58]. Młode pozostają przez kilka miesięcy w płytkich wodach w okolicy miejsca narodzin, by na jesień wyruszyć w kierunku miejsc zimowania na głębszych wodach[28].
Tempo wzrostu żarłaczy czarnopłetwych zmniejsza się z wiekiem: przez pierwsze sześć miesięcy młode rosną 25-30 cm, później 20 cm rocznie, aż do osiągnięcia dwóch lat, następnie 10 cm rocznie, aż do momentu osiągnięcia dojrzałości. Dorosłe osobniki rosną około 5 cm rocznie[59][60]. Wielkość w momencie osiągnięcia dojrzałości jest uzależniona geograficznie: w wodach północno-wschodniego Atlantyku samce i samice dojrzewają przy długości odpowiednio 1,4-1,5 i 1,6 m[28], w Zatoce Meksykańskiej po osiągnięciu 1,3-1,4 i 1,5-1,6 m[59][61], na północy Afryki przy 1,7 i 1,8 m[57] oraz 1,5 i 1,6 m na południu Afryki[62]. Samce dojrzewają w wieku 4-5 lat, zaś samice po 7-8 latach[59][61]. Szacuje się, że rekin ten żyje co najmniej 12 lat[12].
W 2007 roku 9-letnia samica żarłacza czarnopłetwego przetrzymywana w Virginia Aquarium & Marine Science Center zaszła w ciążę, mimo tego, że nigdy nie kopulowała z żadnym samcem. Badanie wykazało pojedynczy żeński embrion. Analiza genetyczna potwierdziła, że młode powstało w wyniku automatycznej partenogenezy, czyli formy bezpłciowego rozmnażania, w której komórka jajowa łączy się ciałkiem kierunkowym, tworząc zygotę bez udziału zapłodnienia. Wraz z wcześniejszym przypadkiem udokumentowania partenogenezy u łopatogłowa (Sphyrna tiburo) zdarzenia te potwierdzają, że rozmnażanie bezpłciowe może być bardziej powszechne wśród rekinów, niż wcześniej sądzono[63].
Analiza mitochondrialnego DNA (ND4) australijskich populacji C. limbatus i C. tilstoni wykazała, że gatunki te krzyżują się w środowisku naturalnym. Spośród wielu zbadanych osobników na hybrydy natrafiono w 5 miejscach u wybrzeży wschodniej Australii. Mimo bliskiego pokrewieństwa gatunki te różnią się pod względem ilości kręgów, wielkości w czasie narodzin oraz w czasie osiągania dojrzałości[64].
Relacje z ludźmi
Rekiny te wykazują ciekawość w obecności nurków, zwykle jednak zachowują bezpieczny dystans. W większości przypadków te nieśmiałe żarłacze nie stwarzają dużego zagrożenia dla ludzi. Jednakże mogą stać się agresywne w obecności pokarmu, co w połączeniu z ich wielkością oraz szybkością może stanowić realne zagrożenie dla ludzi[12]. Do 2008 roku International Shark Attack File zanotowała 28 niesprowokowanych ataków żarłacza czarnopłetwego (w tym jeden śmiertelny) oraz 13 sprowokowanych[65]. U wybrzeży Florydy rekin ten odpowiedzialny jest za 16% przypadków ataków, większość z nich skutkuje zwykle niewielkimi ranami[13].
Jako jeden z bardziej pospolitych dużych rekinów w przybrzeżnych wodach żarłacz czarnopłetwy poławiany jest komercyjnie w dużych ilościach na całym obszarze swojego występowania, zwykle za pomocą sznurów haczykowych, sieci przydennych i włoków. Jego mięso jest wysokiej jakości i sprzedawane bywa w postaci świeżej, mrożonej, suszonej oraz solonej. Ponadto wykorzystuje się jego płetwy jako główny składnik zupy z płetwy rekina, skórę dla potrzeb przemysły garbarskiego oraz olej z wątroby do produkcji preparatów witaminowych. Pozostałe fragmenty przerabia się na mączkę rybną[12].
Żarłacz czarnopłetwy jest jednym z najczęściej poławianych rekinów (drugim po żarłaczu brunatnym) na obszarze północnego Atlantyku. Jego mięso uznaje się za lepsze od mięsa żarłacza brunatnego, dlatego też na terenie Stanów Zjednoczonych mięso C. plumbeus oraz innych przedstawicieli rodzaju Carcharhinus często sprzedaje się jako mięso C. limbatus. Rekin ten ma również duże znaczenie dla indyjskiego i meksykańskiego rybołówstwa. Poławiany jest również w różnych ilościach na obszarze Morza Śródziemnego, u wybrzeży południowych Chin oraz północnej Australii[60].
Popularny gatunek wśród wędkarzy u wybrzeży Florydy, Karaibów i Południowej Afryki, z uwagi na dużą siłę i zwykle długą walkę. Złapany na haczyk często wykonuje spektakularne wyskoki z wody[13]. Od 1995 roku w USA liczba poławianych przez wędkarzy żarłaczy czarnopłetwych przewyższa liczbę osobników pozyskiwanych dla celów komercyjnych[60]. Międzynarodowa Unia Ochrony Przyrody uznała, że rekin ten jest gatunkiem narażonym na wyginięcie, oświadczając również, że stosunkowo powolne tempo reprodukcji czyni go podatnym na przełowienie[9]. Jedynie Stany Zjednoczone oraz Australia monitorują połowy żarłacza czarnopłetwego. W obu przypadkach regulacje te dotyczą również innych gatunków dużych przybrzeżnych rekinów. Brak planów wprowadzenia indywidualnej ochrony dla tego gatunku[60].
Przypisy
- ↑ Carcharhinus limbatus, [w:] Integrated Taxonomic Information System [online] (ang.).
- ↑ D.S. Jordan, Ch.H. Gilbert. Description of four new species of sharks, from Mazatlan, Mexico. „Proceedings of the United States National Museum”. 5, s. 104, 1882. (ang.).
- ↑ C.B. Klunzinger. Synopsis der Fische des Rothen Meeres. „Verhandlungen der Kaiserlich-Königlichen Zoologisch-Botanischen Gesellschaft in Wien wolumin”. 21, s. 661, 1871. (niem.).
- ↑ R.T. Lowe. New species of Madeiran Fishe. „Proceedings of the Zoological Society of London”. 8, s. 38, 1840. (ang.).
- ↑ F. Steindachner. Über einige neue oder seltene Fischarten von Westindien und Surinam. „Sitzungsberichte der Kaiserlichen Akademie der Wissenschaften. Mathematisch-Naturwissenschaftliche Classe”. 56, s. 356, 1867. (niem.).
- ↑ D.S. Jordan, B.W. Evermann. Descriptions of new genera and species of fishes from the Hawaiian Islands. „Bulletin of the United States Fish Commission”. 22, s. 163, 1902. (ang.).
- ↑ P. Bleeker. Bijdeage tot de kennis der plagiostomen van den Indischen Archipel. „Verhandelingen van het Bataviaasch Genootschap der Kunsten en Wetenschappen”. 24, s. 40, ryc. 2, 1852. (niderl. • łac.).
- ↑ S.E. Meek, S.F. Hildebrand. The marine fishes of Panama. „Field Museum of Natural History. Publication. Zoological series”. 15, s. 40, ryc. 1, 1923. (ang.).
- ↑ a b G.H. Burgess, S. Branstetter, Carcharhinus limbatus Northwest Atlantic subpopulation, [w:] The IUCN Red List of Threatened Species 2016 [online], wersja 2016-1 [dostęp 2016-08-24] (ang.).
- ↑ Stanisław Rutkowicz: Encyklopedia ryb morskich. Gdańsk: Wydawnictwo Morskie, 1982. ISBN 83-215-2103-7.
- ↑ J.P. Müller, J. Henle: Systematische Beschreibung der Plagiostomen. Berlin: Veit, 1841, s. 49. (niem.).
- ↑ a b c d e f g h i j k l m n o Compagno, Leonard J.V.: Sharks of the World: An Annotated and Illustrated Catalogue of Shark Species Known to Date. Rzym: Food and Agricultural Organization, 1984, s. 492-493. ISBN 92-5-101384-5.
- ↑ a b c d e f g h i Curtis T.: Biological Profiles: Blacktip Shark. Florida Museum of Natural History Ichthyology Department. [dostęp 2016-02-14]. (ang.).
- ↑ Bigelow H.B., & W.C. Schroeder. 1948. Fishes of the Western North Atlantic, Cz. 1: Sharks. Memoir Sears Found. Mar. Res. New Haven, str. 320, pp: 59-576.
- ↑ Boeseman M. 1960. A tragedy of errors: the status of Carcharhinus Blainville, 1816; Galeolamma Owen, 1853; Eulamia Gill, 1861; and the identity of Carcharhinus commersonii Blainville, 1825. Zoologische Madedelinge, Rijksmuseum van Natuurlijke Historie Leiden, XXXVII(6): 81-100.
- ↑ a b c Carcharhinus limbatus. (ang.) w: Froese, R. & D. Pauly. FishBase. World Wide Web electronic publication. www.fishbase.org [dostęp 25 listopada 2012]
- ↑ a b c Ebert, D.A.: Sharks, Rays, and Chimaeras of California. Londyn: University of California Press, 2003, s. 156-157. ISBN 0-520-23484-7.
- ↑ Garrick, J.A.F. (1982). Sharks of the genus Carcharhinus. NOAA Technical Report, National Marine Fisheries Service. 445-494.
- ↑ Compagno, L.J.V.: Sharks of the Order Carcharhiniformes. Princeton University Press, 1988, s. 319–320. ISBN 0-691-08453-X.
- ↑ Naylor, G.J.P.. The phylogenetic relationships among requiem and hammerhead sharks: inferring phylogeny when thousands of equally most parsimonious trees result. „Cladistics”. 8, s. 295–318, 1992. DOI: 10.1111/j.1096-0031.1992.tb00073.x.
- ↑ Dosay-Akbulut, M.. The phylogenetic relationship within the genus Carcharhinus. „Comptes Rendus Biologies”. 7 (331), s. 500–509, 2008. DOI: 10.1016/j.crvi.2008.04.001. (ang.).
- ↑ Velez-Zuao X. i Agnarsson I.. Shark tales: A molecular species-level phylogeny of sharks (Selachimorpha, Chondrichthyes). „Molecular Phylogenetics and Evolution”, s. 207-217, 2011.
- ↑ Keeney, D.B. i Heist, E.J.. Worldwide phylogeography of the blacktip shark (Carcharhinus limbatus) inferred from mitochondrial DNA reveals isolation of western Atlantic populations coupled with recent Pacific dispersal. „Molecular Ecology”. 12 (15), s. 3669–3679, 2006. DOI: 10.1111/j.1365-294X.2006.03036.x. (ang.).
- ↑ a b Naylor, G.J.P., Caira, J.N., Ensen K.J., Rosana, K.A.M., White, W.T. i Last P.R. A DNA sequence-based approach to the identification of shark and ray species and its implicatons for global elasmobranch diversity and parasitology. „Bulletin American Museum of Natural History”, s. 26, 2012. ISSN 0003-0090. (ang.).
- ↑ G.J.P. Naylor, J.N. Caira, K. Jensen, K.A.M. Rosana, N. Straube i C. Lakner.: Elasmobranch Phylogeny: A mitochondrial estimate based on 595 species. CRC Press, Taylor &Francis Group, 2012, s. 31-56, seria: J.C. Carrier, J.A. Musick and M.R. Heithaus (editors), The Biology of Sharks and Their Relatives. ISBN 978-1-4200-8047-6.
- ↑ Benson. R.N.: Geology and Paleontology of the Lower Miocene Pollack Farm Fossil Site. Delaware: Delaware Geological Survey Special Publication, 1998, s. 133-139.
- ↑ Brown, R.C.: Florida's Fossils: Guide to Location, Identification, and Enjoyment. Florida: Pineapple Press Inc, 2008, s. 100. ISBN 1-56164-409-9.
- ↑ a b c d e Castro, J.I.. Biology of the blacktip shark, Carcharhinus limbatus, off the southeastern United States. „Bulletin of Marine Science”. 3 (59), s. 508–522, 1996.
- ↑ Gavin Naylor, Leslie Floyd Marcus. Identifying isolated shark teeth of the genus Carcharhinus to species, relevance for tracking phyletic change through the fossil record. „American Museum Novitates”, s. 53, 1994. ISSN 0003-0082.
- ↑ Motta, P., Habegger, M.L., Lang, A., Hueter, R. i Davis, J.. Scale Morphologyand Flexibility in the Shortfin Mako Isurus oxyrinchus and the Blacktip Shark Carcharhinus limbatus. „Journal of Morphology”. 10 (110), s. 8-10, 2012. DOI: 10.1002/jmor.20083.
- ↑ Sancho-Vazquez, F., Del Moral-Flores, L.F. i Mendoza-Vargas, O.U.. Albinismo parcial en un embrión de tiburón puntas negras, Carcharhinus limbatus (Carcharhinidae: Chondrichthyes) del Pacífico oriental. „Latin American Journal of Aquatic Research”. 1 (43), s. 274-276, 2015. DOI: 10.3856/vol43-issue1-fulltext-25. (hiszp.).
- ↑ a b Voigt, M. i Weber, D.: Field Guide for Sharks of the Genus Carcharhinus. Verlag Dr. Friedrich Pfeil, 2011, s. 99-110. ISBN 978-3-89937-132-1.
- ↑ Heupel, M.R. i Simpfendorfer, C.A.. Quantitative analysis of aggregation behavior in juvenile blacktip sharks. „Marine Biology”, s. 1239-1249, 2005. DOI: 10.1007/s00227-005-0004-7. (ang.).
- ↑ Ritter, E.K. i Godknecht, A.J. Agonistic Displays in the Blacktip Shark (Carcharhinus limbatus). „Copeia”. 1 (2000), s. 282–284, 2000. DOI: [0282:ADITBS2.0.CO;2 10.1643/0045-8511(2000)2000[0282:ADITBS]2.0.CO;2]. (ang.).
- ↑ a b Ritter, E. K.. Analysis of sharksucker, Echeneis naucrates, induced behavior patterns in the blacktip shark, Carcharhinus limbatus. „Environ. Biol. Fishes”, s. 111-115, 2002. DOI: 10.1023/A:1019642221755. (ang.).
- ↑ Riner, E.K. i Brijnnschweiler, J.M.. Do sharksuckers, Echeneis naucrates, induce jump behaviour in blacktip sharks, Carcharhinus limbatus?. „Marine and Freshwater Behaviour and Physiology”. 2 (36), s. 111-113, 2003. DOI: 10.1080/1023624031000119584.
- ↑ Brunnschweiler, J.M.. Water-escape velocities in jumping blacktip sharks. „Journal of the Royal Society Interface”. 4 (2), s. 389-391, 2005. DOI: 10.1098/rsif.2005.0047. (ang.).
- ↑ Jensen, K. i Bullard, S.A.. Characterization of a diversity of tetraphyllidean and rhinebothriidean cestode larval types, with comments on host associations and life cycles. „International Journal for Parasitology”. 8 (40), s. 889-910, 2010. DOI: 10.1016/j.ijpara.2009.11.015.
- ↑ Schmidt, G.D. i Beveridge, I.. Cathetocephalus australis n. sp. (Cestoidea: Cathetocephalidae) from Australia, with a proposal for Cathetocephalidea. „Journal of Parasitology”. 3 (76), s. 337-339, 1990.
- ↑ a b c Palm, H.W.: The Trypanorhyncha Diesing. PKSPL-IPB Press, 1863. ISBN 979-9336-39-2.
- ↑ Palm, H.W. i Overstreet, R.M.. New records of trypanorhynch cestodes from the Gulf of Mexico, including Kotorella pronosoma (Stossich, 1901) and Heteronybelinia palliata (Linton, 1924) comb. n.. „Folia Parasitologica”. 4 (47), s. 293-302, 2000.
- ↑ Pramanik, P.B. i Manna, B.. Six new and two known species of the Genus Tylocephalum Linton, 1890 (Cestoida: Lecanicephalidae) in cartilageous fishes from Bay of Bengal at Digha coastal waters, West Bengal, India. „Journal of Natural History India”. 2 (3), s. 12-22, 2007.
- ↑ Caira, J.N., Richmond, C., Swanson, J.. A revision of Phoreiobhrium (Tetraphyllidea: Onchobothriidae) with descriptions of five new species. „Journal of Parasitology”. 91 (5), s. 1153-1174, 2005. DOI: 10.1645/GE-3459.1.
- ↑ Glesson, R.J., Bennett, M.B. i Adlard, R.D.. First taxonomic description of multivalvulidan myxosporean parasites from elasmobranchs: Kudoa hemiscylli n.sp. and Kudoa carcharhini n.sp. (Myxosporea: Multivalvulidae). „Parasitology”. 13 (137), s. 1885-1898, 2010. DOI: 10.1017/S0031182010000855.
- ↑ Hendrix, S.S.. Marine Flora and Fauna of the Eastern United States. Platyhelminthes: Monogenea. „NOAA Technical Report NMFS”, s. 108, 1994.
- ↑ Merlo-Serna, I.A. i Garcia-Prieto, L.. A checklist of helminth parasites of Elasmobranchii in Mexico. „Zookey”, s. 73-128, 2016. DOI: 10.3897/zookeys.563.6067.
- ↑ Cressey R.F.. Revision of the family Pandaridae (Copepoda: Caligoida). „Proceedings of the United States National Museum”. 3570 (121), s. 133, 1967.
- ↑ Cressey. R.F.. Copepods parasites on sharks from the west coast of Florida. „Smithsonian Contributions to Zoology”, s. 1-30, 1970.
- ↑ Ota, Y.. Pigmentation patterns are useful for species identification of third-stage larvae of gnathiids (Crustacea: Isopoda) parasitising coastal elasmobranchs in southern Japan. „Systematic Parasitology”. 3 (90), s. 269-284, 2015. DOI: 10.1007/s11230-015-9548-1.
- ↑ Sawyer, R.T., Lawler, A.R. i Overstreet, R.M.. Marine leeches of the eastern United States and Gulf of Mexico with a key to the species. „Journal of Natural History”. 6 (9), s. 633-667, 1975. DOI: 10.1080/00222937500770531.
- ↑ a b c Barry K.P.: Feeding habits of blacktip sharks, Carcharhinus limbatus, and Atlantic sharpnose sharks, Rhizoprionodon terraenovae, in Louisiana coastal waters. Baton Rouge: MS thesis, Louisiana State University, 2002.
- ↑ a b Dudley, S.F.J. i Cliff, G.. Sharks caught in the protective gill nets off Natal, South Africa. 7. The blacktip shark Carcharhinus limbatus (Valenciennes). „African Journal of Marine Science”. 1 (13), s. 237–254, 1993. DOI: 10.2989/025776193784287356. (ang.).
- ↑ Rafael Tavares. Occurrence, Diet and Growth of Juvenile Blacktip Sharks, Carcharhinus limbatus, from Los Roques Archipelago National Park, Venezuela. „Caribbean Journal of Science”. 3 (44), s. 296-297, 2008. (ang.).
- ↑ a b Keeney, D.B., Heupel, M., Hueter, R.E. i Heist, E.J. Genetic heterogeneity among blacktip shark, Carcharhinus limbatus, continental nurseries along the U.S. Atlantic and Gulf of Mexico. „Marine Biology”, s. 1039-1046, 2003. DOI: 10.1007/s00227-003-1166-9.
- ↑ Bornatowski, H.. A parturition and nursery area for Carcharhinus limbatus (Elasmobranchii, Carcharhinidae) off the coast of Paraná, Brazil. „Brazilian Journal of Oceanography”. 4 (56), s. 317-319, 2008. DOI: 10.1590/s1679-87592008000400008.
- ↑ Keeney, D.B., Heupel, M.R., Hueter, R.E. i Heist, E.J.. Microsatellite and mitochondrial DNA analyses of the genetic structure of blacktip shark (Carcharhinus limbatus) nurseries in the northwestern Atlantic, Gulf of Mexico, and Caribbean Sea. „Molecular Ecology”. 7 (14), s. 1911-1923, 2005. DOI: 10.1111/j.1365-294X.2005.02549.x.
- ↑ a b c Capapé, C.H., Seck, A.A., Diatta, Y., Reynaud, C.H., Hemida, F. i Zaouali, J.. Reproductive biology of the blacktip shark, Carcharhinus limbatus (Chondrichthyes: Carcharhinidae) off West and North African Coasts. „Cybium”. 4 (28), s. 275–284, 2004.
- ↑ Heupel, M.R. i Simpfendorfer, C.A.. Estimation of mortality of juvenile blacktip sharks, Carcharhinus limbatus, within a nursery area using telemetry data. „Canadian Journal of Fisheries and Aquatic Sciences”. 4 (59), s. 624–632, 2002. DOI: 10.1139/f02-036.
- ↑ a b c Branstetter, S.. Age and Growth Estimates for Blacktip, Carcharhinus limbatus, and Spinner, C. brevipinna, Sharks from the Northwestern Gulf of Mexico. „Copeia”. 4 (1987), s. 964-974, 1987. American Society of Ichthyologists and Herpetologists. DOI: 10.2307/1445560.
- ↑ a b c d Fowler, S.L., Cavanagh, R.D., Camhi, M., Burgess, G.H., Cailliet, G.M., Fordham, S.V., Simpfendorfer, C.A. i Musick, J.A.: Sharks, Rays and Chimaeras: The Status of the Chondrichthyan Fishes. International Union for Conservation of Nature and Natural Resources, 2005, s. 106–109, 293–295. ISBN 2-8317-0700-5.
- ↑ a b Killam, K.A. i Parsons, G.R.. Age and Growth of the Blacktip Shark, Carcharhinus limbatus, near Tampa Bay. „Florida Fishery Bulletin”, s. 845-857, 1989.
- ↑ Wintner, S.P. i Cliff, G.. Age and growth determination of the blacktip shark, Carcharhinus limbatus, from the east coast of South Africa. „Fishery Bulletin”. 1 (94), s. 135–144, 1996.
- ↑ Chapman, D.D., Firchau, B. i Shivji, M.S.. Parthenogenesis in a large-bodied requiem shark, the blacktip Carcharhinus limbatus. „Journal of Fish Biology”, s. 1473–1477, 2008. 73. DOI: 10.1111/j.1095-8649.2008.02018.x.
- ↑ Morgan J.A.T, Harry A.V. Welch D.J, Street R., White J., Geraghty P.T., Macbeth W.G., Tobin A. i Simpfendorfer C.A. Detection of interspecies hybridisation in Chondrichthyes: hybrids and hybrid offspring between Australian (Carcharhinus tilstoni) and common (C. limbatus) blacktip shark found in an Australian fishery. „Conservation Genetics”. 2 (13), s. 455-463, 2012. DOI: 10.1007/s10592-011-0298-6.
- ↑ International Shark Attack File, Florida Museum of Natural History: ISAF Statistics on Attacking Species of Shark.. University of Florida, 2008. [dostęp 2016-08-04].
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
Autor: Mozcashew1, Licencja: CC BY-SA 4.0
Mike Rutzen pits a shark into Tonic Immobility
Autor: Chris_huh, Licencja: CC-BY-SA-3.0
Distribution map for Carcharhinus limbatus
Blacktip shark (Carcharhinus limbatus) in Pokai Bay, Oahu
| Opis | Carcharhinus limbatus |
| Data | |
| Źródło | Walers Cay Bahamas |
| Autor | Albert Kok |
| Licencja (Ponowne użycie tego pliku) |
Public Domain |
C.limbatus2
Autor: Amada44, Licencja: CC BY 3.0
A blacktip shark (Carcharhinus limbatus) in UShaka Sea World
Blacktip shark (Carcharhinus limbatus ). Gulf of Mexico.
Blacktip shark (Carcharhinus limbatus)