Aceton
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C3H6O | ||||||||||||||||||||||||||||||||||||
| Inne wzory | CH 3−CO−CH 3, CH 3COCH 3, CO(CH 3) 2, CH 3−C(O)−CH 3 | ||||||||||||||||||||||||||||||||||||
| Masa molowa | 58,08 g/mol | ||||||||||||||||||||||||||||||||||||
| Wygląd | lotna, przezroczysta, bezbarwna ciecz[1] o ostrym zapachu | ||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||
| Numer CAS | 67-64-1 | ||||||||||||||||||||||||||||||||||||
| PubChem | 180 | ||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||
| Podobne związki | propan, butanon, izopropanol, diacetyl, DMSO | ||||||||||||||||||||||||||||||||||||
| Pochodne | bromoaceton, chloroaceton, dichloroaceton, hydroksyaceton, dihydroksyaceton, acetyloaceton | ||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||||||||||
| Legalność w Polsce | prekursor narkotykowy kategorii 3 | ||||||||||||||||||||||||||||||||||||
Aceton, propanon, keton metylowy[8] – organiczny związek chemiczny z grupy ketonów, najprostszy keton alifatyczny. Ma ostry, charakterystyczny zapach. Miesza się w każdych proporcjach z wodą, etanolem, eterami i innymi ketonami o niskiej masie cząsteczkowej.
Występowanie i otrzymywanie
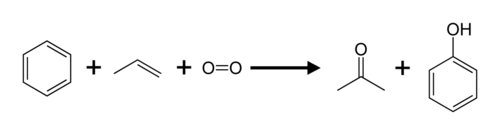
Aceton obecny jest w niewielkich ilościach w krwi i moczu. Większe od normy jego stężenie pojawia się w organizmie przy zaawansowanej i nieleczonej cukrzycy. Aceton jest naturalnie obecny w tkankach wielu roślin (np. ziemniaków, żyta), gazach wulkanicznych i gazach spalinowych. Tworzy się on w dużych ilościach w trakcie suchej destylacji drewna, która była niegdyś głównym sposobem jego produkcji. Obecnie w przemyśle produkuje się go najczęściej metodą kumenową przy okazji otrzymywania fenolu.
W laboratorium można go otrzymać przez suchą destylację octanu wapnia.
Aceton wytwarzany jest efektywnie przez bakterie Clostridium acetobutylicum. Proces ten został opisany po raz pierwszy w latach 1904–1907, natomiast wykorzystany w praktyce do przemysłowej produkcji acetonu w roku 1915[9] przez brytyjskiego biochemika pochodzenia żydowskiego Chaima Weizmana, późniejszego pierwszego prezydenta państwa Izrael. W okresie I wojny światowej występowało duże zapotrzebowanie na aceton, niezbędny składnik kordytu (rodzaj prochu bezdymnego), natomiast działania wojenne uniemożliwiały Wielkiej Brytanii import octanu wapnia, prekursora acetonu. Technologia opracowana przez Weizmana umożliwiła produkcję acetonu na dużą skalę. Ponieważ pożywkę dla C. acetobutylicum przygotowywano z deficytowej kukurydzy, konieczne było przeniesienie produkcji do Kanady (1916) i USA (1917). Weizman w zamian za swoje zasługi zasugerował swoje poparcie dla idei państwa żydowskiego w Palestynie, co w dużej mierze przyczyniło się do uchwalenia deklaracji Balfoura[10][11][12].
Obecnie otrzymywany jest głównie na skalę przemysłową metodą kumenową z propylenu, a także katalitycznie z alkoholu izopropylowego, acetylenu w wyniku fermentacji butanolowo-acetonowej.
Zastosowanie

Aceton jest powszechnie stosowanym rozpuszczalnikiem organicznym o dużej polarności. Rozpuszcza większość miękkich tworzyw sztucznych, lakiery, tłuszcze, oleje (nawet nagar silnikowy). Dobrze rozpuszcza się w nim acetylen, przez co używa się go w butlach na ten gaz w celu uniknięcia zbyt wysokiego ciśnienia, pod którym acetylen jest niestabilny[13]. Stosuje się go przy produkcji leków, barwników, farb, lakierów i środków czyszczących. Jest często stosowany jako składnik zmywacza do paznokci.
Aceton może być wykorzystywany jako prekursor do produkcji narkotyków i w związku z tym obrót nim podlega w Polsce kontroli, zgodnie z Ustawą o przeciwdziałaniu narkomanii[14] oraz rozporządzeniami Wspólnoty Europejskiej[15][16][17]. Jednak z uwagi na to, że aceton należy do prekursorów niskiej kategorii (trzeciej), przepisy nie ograniczają jego dostępności w handlu detalicznym.
Szkodliwość
Aceton jest substancją wysoce łatwopalną. Działa drażniąco na oczy, wysusza skórę i może wywołać uczucie senności lub zawroty głowy[6]. Jego LD50 wynosi 5,8 g/kg (szczur, doustnie)[6] (dla porównania dla alkoholu etylowego jest to 10,5 g/kg)[18]. W klasyfikacji toksyczności według Hodge’a i Sternera aceton należy do grupy słabo toksycznych. Według kryteriów UE substancje o LD50 powyżej 2 g/kg nie są klasyfikowane jako toksyczne. Opary acetonu łatwo wchłaniają się przez płuca do krwi, która rozprowadza ten związek po całym organizmie. Jeśli stężenie acetonu we krwi nie jest zbyt wysokie, jest on skutecznie metabolizowany przez wątrobę. W większym stężeniu aceton zaczyna powodować ostre podrażnienia błon śluzowych nosa i ust oraz łzawienie oczu i ból głowy. Duże stężenie acetonu w powietrzu powoduje utratę przytomności i śpiączkę (LC50 50,1 g/m³/8 h; szczur, wdychanie[6]). Nie stwierdzono, aby miał działanie genotoksyczne lub rakotwórcze[19].
Przypisy
- ↑ a b c d Farmakopea Polska IX, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2011, s. 4574, ISBN 978-83-88157-77-6.
- ↑ a b c d CRC Handbook of Chemistry and Physics, David R. Lide (red.), wyd. 90, Boca Raton: CRC Press, 2009, s. 3–4, ISBN 978-1-4200-9084-0 (ang.).
- ↑ CRC Handbook of Chemistry and Physics, David R. Lide (red.), wyd. 90, Boca Raton: CRC Press, 2009, s. 6–176, ISBN 978-1-4200-9084-0 (ang.).
- ↑ CRC Handbook of Chemistry and Physics, David R. Lide (red.), wyd. 90, Boca Raton: CRC Press, 2009, s. 9–52, ISBN 978-1-4200-9084-0 (ang.).
- ↑ acetone (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2015-03-09].
- ↑ a b c d e f g Aceton (nr 650501) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2019-06-28]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Acetone (nr 650501) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Stanów Zjednoczonych. [dostęp 2019-06-28]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Stefan Chudzyński, Jan Puternicki, Wiktor Surowiak: 1000 słów o tworzywach sztucznych. Wydawnictwo Ministerstwa Obrony Narodowej, 1981, s. 10. ISBN 83-11-06641-8. (pol.)
- ↑ C. Weizmann C, „Improvements in the bacterial fermentation of carbohydrates and in bacterial cultures for the same” British patent 4845 (1915).
- ↑ Peter Dürre, New insights and novel developments in clostridial acetone/butanol/isopropanol fermentation, „Applied Microbiology and Biotechnology”, 49 (6), 1998, s. 639–648, DOI: 10.1007/s002530051226.
- ↑ Janusz Pajewski: Pierwsza wojna światowa 1914-1918. Warszawa: PWN, 2004, s. 348–349.
- ↑ Encyklopedia Britannica – edycja polska. Wyd. 1. T. 45. Poznań: Wydawnictwo Kurpisz, 2005, s. 368.
- ↑ Wytyczne bezpiecznego postępowania. 10. Postępowanie z acetylenem, Linde Gaz Polska, 2012 [zarchiwizowane z adresu 2016-03-04].
- ↑ Ustawa z dnia 29 lipca 2005 r. o przeciwdziałaniu narkomanii (Dz.U. z 2020 r. poz. 2050).
- ↑ Rozporządzenie (WE) nr 273/2004 Parlamentu Europejskiego i Rady z dnia 11 lutego 2004 r. w sprawie prekursorów narkotykowych (CELEX: 32004R0273).
- ↑ Rozporządzenie Rady (WE) nr 111/2005 z dnia 22 grudnia 2004 r. określające zasady nadzorowania handlu prekursorami narkotyków pomiędzy Wspólnotą a państwami trzecimi (CELEX: 32005R0111).
- ↑ Rozporządzenie Komisji (WE) nr 1277/2005 z dnia 27.07.2005 r. ustanawiające przepisy wykonawcze dotyczące rozporządzenia (WE) nr 273/2004 Parlamentu Europejskiego i Rady w sprawie prekursorów narkotykowych i rozporządzenia Rady (WE) nr 111/2005 określającego zasady nadzorowania handlu prekursorami narkotyków pomiędzy Wspólnotą a państwami trzecimi (CELEX: 32005R1277).
- ↑ Etanol (nr 46139) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2019-06-28]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Acetone. CASRN 67-64-1. IRIS Summary, [w:] Integrated Risk Information System [online], U.S. Environmental Protection Agency, 2003 [dostęp 2019-06-28].
Linki zewnętrzne
- acetone, [w:] Chemical Entities of Biological Interest [online], European Bioinformatics Institute, CHEBI:15347 (ang.).
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Structural formula of the acetone molecule, Me2CO, C3H6O.
Structural information (determined by gas-phase electron diffraction and microwave spectroscopy) from CRC Handbook, 88th edition.Autor: Simon A. Eugster, Licencja: CC BY-SA 3.0
A drop of Acetone on Styrofoam
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances