Aga (ropucha)
| Rhinella marina[1] | |||||
| (Linnaeus, 1758) | |||||
| Okres istnienia: miocen–dziś | |||||
(c) Froggydarb, CC-BY-SA-3.0 | |||||
| Systematyka | |||||
| Domena | |||||
|---|---|---|---|---|---|
| Królestwo | |||||
| Typ | |||||
| Podtyp | |||||
| Gromada | |||||
| Rząd | |||||
| Podrząd | |||||
| Rodzina | |||||
| Rodzaj | |||||
| Gatunek | aga | ||||
| |||||
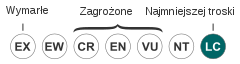
| Kategoria zagrożenia (CKGZ)[3] | |||||
 | |||||
| Zasięg występowania | |||||
 Na niebiesko zaznaczono naturalne występowanie agi, na czerwone miejsca, gdzie dostała się za sprawą człowieka | |||||
Aga, kururu, ropucha olbrzymia (Rhinella marina[4]) – gatunek płaza z rodziny ropuchowatych pochodzący z Ameryki Środkowej i Południowej, introdukowany na licznych wyspach Oceanii i Karaibów. Jest to lądowa ropucha. Zalicza się do rodzaju Rhinella uznawanego niekiedy za podrodzaj rodzaju Bufo, obejmującego wiele różnorodnych ropuchowatych Ameryki Środkowej i Południowej. Jest bardzo płodna – samice składają skrzek w pojedynczym kłębie zawierającym tysiące jaj. Sukces reprodukcyjny wynika po części z oportunizmu w odżywianiu się: aga cechuje się nietypową wśród bezogonowych dietą, spożywając zarówno żywy, jak i martwy pokarm. Obfitość pokarmu skłania ją do zasiedlania ogrodów, parków a nawet wysypisk śmieci, ruder czy wszelkich terenów w pobliżu człowieka[5]. Osobniki dorosłe osiągają 10–15 cm długości. Masa ciała najcięższego odnotowanego osobnika osiągnęła 2,65 kilograma, przy długości 38 cm (od czubka pyska do kloaki).
Jest to stary gatunek. Skamieniałości oznaczone jako UCMP 41159 wchodzące w skład kolumbijskiej fauny La Venta z późnego miocenu są niemożliwe do odróżnienia od dzisiejszej agi z północnej Ameryki Południowej[6]. Odkryto je w skałach powstałych w środowisku równiny zalewowej, co sugeruje, że aga zawsze preferowała tereny otwarte[7].
Ropucha ta ma produkujące toksynę gruczoły, a kijanki w przypadku połknięcia są wysoce toksyczne dla większości zwierząt. Z powodu nieposkromionego apetytu agę introdukowano w wielu miejscach jako sposób na kontrolę szkodników rolniczych. Anglojęzyczna nazwa gatunku cane toad (ropucha trzcinowa) bierze źródłosłów z powodu używania ropuchy przeciwko Dermolepida albohirtum. Obecnie jednak to agę uważa się za szkodnika i gatunek inwazyjny na wielu terenach introdukcji. Szczególną uwagę zwraca się na ginięcie rodzimych drapieżników w wyniku kontaktu z jej toksyczną skórą, także w przypadku połknięcia.
Systematyka
Pierwotnie agi używano do walki ze szkodnikiem trzciny cukrowej (ang. sugar cane), od czego wzięła się anglojęzyczna nazwa ropuchy cane toad (toad oznacza ropuchę). W rzeczonym języku ma ona wiele nazw potocznych, jak giant toad (ropucha olbrzymia) i marine toad (ropucha morska). Pierwsza nazwa odnosi się do wielkich rozmiarów zwierzęcia; następna zaś do nazwy binominalnej, naukowej nazwy płaza Bufo marinus. Był to jeden z wielu gatunków opisanych jeszcze przez Linneusza w wydanej w 1735 Systema Naturae[8]. Przyrodnik oparł stworzony przez siebie epitet gatunkowy marinus na ilustracji wykonanej przez holenderskiego zoologa Alberta Sebę, który niezgodnie z prawdą uważał, że zwierzę zamieszkuje zarówno środowiska lądowe, jak i morskie[9]. Inne potoczne nazwy to giant neotropical toad (wielka ropucha neotropikalna)[10], dominican toad (ropucha dominikańska)[11], giant marine toad (wielka ropucha morska)[12] i South American cane toad (południowoamerykańska ropucha trzcinowa)[13]. W trynidadzkim angielskim płazy te nazywa się crapaud, francuskojęzycznym słowem oznaczającym ropuchę[14].
Podrodzaj Rhinella jest coraz częściej uznawany za oddzielny rodzaj, co zmienia nazwę naukową agi. W tym przypadku linneuszowski epitet gatunkowy marinus zmienia się na marina, by korespondował z nazwą rodzajową zgodnie z zasadami odmiany przymiotników łacińskich i International Code of Zoological Nomenclature. Tak więc zamiast Bufo marinus zwierzę nazywa się w takim ujęciu Rhinella marina. Binominalna nazwa Rhinella marinus była później wprowadzona jako synonim z powodu błędu popełnionego przez Pramuka, Robertsona, Sitesa i Noonana (2008)[15][16]. Choć kontrowersyjna (wielu herpetologów tradycjonalistów używa wciąż Bufo marinus), nazwa binominalna Rhinella marina została zaakceptowana m.in. przez IUCN[17], Encyclopedia of Life[18], Amphibian Species of the World[15]. Badania DNA mitochondrialnego i jądrowego wskazują, że Rhinella obejmować powinna wszystkie południowoamerykańskie płazy umieszczane przedtem w rodzaju Bufo[19].
Agę włącza się też w grupę gatunków zwaną grupą Rhinella marina. Zalicza się doń 10 gatunków o masywnych ciałach, zamieszkujących tereny od Teksasu na północy do Urugwaju na południu: Rhinella marina (Linnaeus, 1758), Rhinella icterica (Spix, 1824), Rhinella poeppigii (Tschudi, 1845), Rhinella arenarum (Hensel, 1867), Rhinella schneideri (Werner, 1894), Rhinella rubescens (A. Lutz, 1925), Rhinella jimi (Stevaux, 2002), Rhinella achavali (Maneyro, Arrieta and de Sá, 2004), Rhinella veredas (Brandão, Maciel & Sebben, 2007) i Rhinella cerradensis Maciel, Brandão, Campos & Sebben, 2007[19].
W Australii osobniki dorosłe mogą być mylone z wielkimi miejscowymi bezogonowymi z rodzajów Limnodynastes, Cyclorana i Mixophyes. Zaliczające się do nich gatunki odróżniają się od agi nieobecnością u kijanek gruczołów przyusznych za oczami oraz brakiem linijnego wzniesienia pomiędzy nozdrzem zewnętrznym i okiem[20]. Agę można pomylić z zagrzebnicą wielką, ponieważ oba płazy są dużych rozmiarów i brodawkowate w wyglądzie. Ten drugi wyróżnia się jednak pionową źrenicą i srebrzystoszarą tęczówką, podczas gdy pierwszy ma złotą[21]. Młodociane agi myli się też z przedstawicielami rodzaju Uperoleia, jednak dojrzałe odróżniają się od nich brakiem jasnego ubarwienia w pachwinach i na udach[22].
W Stanach Zjednoczonych Ameryki żyje wiele gatunków ropuchowatych bardzo podobnych do agi. W szczególności należy do nich Bufo terrestris, wyróżniająca się obecnością dwóch wybrzuszeń na przodzie parotydów[23].
Ewolucja
Kladogram z mawianej pracy Medeiros Maciel et al, 2010[19]:
|
Filogenezę grupy Rhinella marina omawia praca Medeirosa Maciela i współpracowników opublikowana w 2010, w której użyli analizy Bayesa i największej zgodności do opracowania materiału z badań genetycznych, morfologicznych i chromatograficznych wydzielin gruczołów[19].
Sama rodzina ropuchowatych pojawiła się wedle starszych prac Savage'a (1973) i Pramuka (2006) jeszcze przed rozpadem superkontynentu Gondwany, nowsza o 2 lata publikacja Pramuka i współpracowników podaje już czas po rozpadzie wielkiego południowego lądu, między 78 i 99 milionów lat temu[19].
Pierwszy rozłam w obrębie omawianej grupy gatunków nastąpił około 10,47 miliona lat temu, co przypada na późny miocen. Nastąpiło wtedy uniesienie Brazilian Central Shield, co wiązało się z drastycznymi zmianami w krajobrazie i powstaniem barier geograficznych. Spowodowało to pierwsze różnicowanie w obrębie grupy, miało też wpływ na kolejny podział. W późnym miocenie rozdzielenie linii zdążyło jeszcze zajść 8,08 miliona lat temu w środkowej Brazylii (powstał wtedy przodek kladu nazywanego przez autorów północno-środkowym, złożonego z R. poeppigii, R. cerradensis, R. schneideri, R. marina, R. jimi i R. veredas), bardziej na północy, niż kolejne podobne wydarzenie, które datuje się na wczesny pliocen (5,17 milionów lat temu) i umiejscawia bardziej na południe od poprzedniego. Napotkawszy odpowiednie środowisko, ropuchy z kladu północno-środkowego rozprzestrzeniały się. Aga i R. poeppigii wyróżniają się w nim bardziej jedwabistą skórą i zamieszkują lasy, pozostali członkowie, których skóra jest bardziej szorstka, żyją w bardziej suchych siedliskach. Wpłynęło to na wcześniejsze zróżnicowanie kladu północno-środkowego, w porównaniu do południowo-środkowego. W pliocenie różnorodny opad deszczu spowodował wykształcenie mozaiki różnych środowisk. 3 miliony lat temu pojawiło się połączenie lądowe pomiędzy Ameryką Południową i Północną, które umożliwiło ropuchom przebycie terenów Przesmyku Panamskiego. Nowe tereny lądowe, wypiętrzanie się Andów i powstawanie Amazonki na granicy miocen-pliocen wywarły wpływ na ewolucję gatunków północnych. Ostatni rozłam w grupie nastąpił około 1,55 milionów lat temu, co przypada na plejstocen[19].
Nie ma jednak pewności co do położenia agi w obrębie tej grupy gatunków. Być może tworzy ona klad z Rhinella jimi[19].
Budowa
Aga osiąga bardzo duże rozmiary[24], samice są znacznie dłuższe od samców[25], osiągając średnią długość 10–15 cm[24]. Źródła podają także wymiar 24 cm[26]. "Prinsen", osobnik trzymany jako zwierzę domowe w Szwecji, został odnotowany przez Księgę Rekordów Guinnessa jako największy znany osobnik. Masa ciała najcięższego odnotowanego osobnika osiągnęła 2,65 kilograma, przy długości mierzonej od czubka pyska do kloaki – 38 cm, oraz 54 cm przy pomiarze ciała w pełni rozciągniętego[27]. Większe osobniki znajduje się raczej w okolicach o mniejszym zagęszczeniu[28]. Na wolności długość życia wynosi od 10 do 15 lat[29], w niewoli może być znacznie dłuższa. Jeden z osobników przeżył 35 lat[30].
Skóra agi jest sucha i pokryta brodawkami[24]. Ponad oczami znajdują się wydatne grzebienie, biegnące w dół do pyska[20]. Ubarwienie może być szare, żółtawe, czerwonobrązowe, oliwkowobrązowe, zdobione zmiennymi wzorami[31]. Duże parotydy znajdują się za oczami[24]. Brzuszna strona ciała jest barwy kremowej, z ciemnym cętkowaniem koloru czarnego lub brązowego. Źrenice ustawione są horyzontalnie, otoczone złotymi tęczówkami[21]. Palce kończyn dolnych dysponują mięsistymi błonami pławnymi przy podstawach[24], których nie ma na kończynach górnych[31].
Osobniki młodociane są znacznie mniejsze od dorosłych; osiągają 5−20 cm długości. Cechują się gładką, ciemną skórą, niekiedy pojawia się też czerwień. Od dorosłych odróżnia je brak wielkich parotydów, wobec czego są zazwyczaj mniej toksyczne[28]. Kijanki, ubarwione jednolicie na czarno, osiągają niewielkie rozmiary. Żyją przy dnie zbiornika wodnego, tworząc "szkółki"[32]. Mierzą od 1,0 do 2,5 cm długości[33].
Ekologia, zachowanie i cykl życiowy
Anglojęzyczna nazwa zwyczajowa marine toad i nazwa naukowa Bufo marinus (obie znaczą „ropucha morska”) sugerują związek ze środowiskiem morskim[34], jednakże dorosłe agi prowadzą całkowicie lądowy tryb życia. Wody słodkie odwiedzają jedynie w celach rozrodczych. Kijanki znajdowano w umiarkowanie słonej wodzie o zasoleniu do 15% zasolenia wody morskiej[35]. Ropucha ta zamieszkuje otwarte tereny trawiaste i zadrzewione, wykazując wyraźną preferencję dla rejonów zmodyfikowanych działalnością ludzką, jak ogrody i rowy melioracyjne[36]. W jej naturalnym siedlisku osobniki znajdywano w lasach podzwrotnikowych[33], choć gęste listowie wydaje się ograniczać jej rozprzestrzenienie[37].
Maksimum termiczne agi ocenia się na 40–42 °C, a minimum na 10–15 °C[38]. Zakres ten może ulegać zmianom dzięki adaptacji do lokalnych warunków środowiskowych[39]. Zwierzę wykazuje wysoką tolerancję utraty wody. Jedno z badań pokazało, że niektóre osobniki wytrzymują nawet utratę 52,6% wody ze swego ciała, co pozwala na przetrwanie poza klimatem tropikalnym[39].
Cykl życiowy
Cykl życiowy agi rozpoczyna się od jaja, składanego do wody jako część długich galaretowatych sznurów. Samica składa za jednym razem od 8000 do 25000[34], a nawet ponad 30000 jaj, poświęcając na ich złożenie 2-3 godziny[26]. Tworzone przez nie sznury mogą osiągać nawet do 20 m długości[34]. Ciemne jajo pokrywa błona, której średnica wynosi zwykle 1,7–2,0 mm[34]. Szybkość, z jaką z jaja tworzy się larwa zwana kijanką, zależy od temperatury i wzrasta proporcjonalnie do niej. Kijanki zwykle wykluwają się po 48 godzinach, ale okres ten może trwać od 14 godzin do tygodnia[34]. Wolno pływające i spożywające pokarm kijanki obserwowano po 70–96 godzinach[26]. W wyniku tego procesu powstają tysiące niewielkich, czarnych larw o krótkich ogonach, tworzących grupy. Po upływie 12 do 60 dni przeistaczają się w małe ropuszki. Proces ten zazwyczaj trwa 4 tygodnie[34]. Podobnie jak w przypadku osobników dorosłych, jaja i kijanki są dla wielu zwierząt toksyczne[24].
Po przeobrażeniu ropuchy mierzą zwykle 10–11 mm długości. Rosną szybko; ich tempo wzrostu zależy od regionu, pory roku i płci. Zug & Zug oszacowali średnie tempo wzrostu na 0,647 mm dziennie, a później 0,373 mm na dzień. Wzrost zazwyczaj ulega spowolnieniu, gdy ropucha osiąga dojrzałość płciową[40]. Tak szybki wzrost jest ważny dla przeżycia, gdyż w okresie pomiędzy metamorfozą i czasem poprzedzającym dorosłość młode ropuchy tracą toksyczność chroniącą jaja i kijanki, nie rozwinąwszy jeszcze w pełni parotydów produkujących bufotoksynę[41]. Ponieważ nie są wtedy chronione przez toksynę, ocenia się, że tylko 0,5% osobników osiąga dorosłość[28][42]. W warunkach laboratoryjnych, przy odpowiednich technikach hodowli, dożywa nawet 40 lat[19].
Larwy agi, żywiące się zazwyczaj glonami, wykazują praktyki kanibalistyczne: zjadają jaja własnego gatunku, nawet z pominięciem jaj innych bezogonowych (obcogatunkowy skrzek był jedzony tylko w warunkach laboratoryjnych, gdy nie podawano innego pożywienia; jest to zachowanie wyjątkowe, australijskie bezogonowe konsumują jaja bez względu na gatunek). Skrzek przyciąga je wydzielanymi mediatorami chemicznymi. Próbowano wyjaśnić kanibalizm agi na 3 sposoby. Wysunięta hipoteza transferu toksyn, których stężenie w jajach osiąga wyższe wartości, niż w kijankach, okazała się chybiona. Spożyte toksyny nie akumulują się w larwach. Zachowanie to tłumaczy się więc wysoką zawartością substancji odżywczych w jajach, a także zmniejszeniem konkurencji. Większy odsetek kanibalistycznych kijanek przystępuje do metamorfozy, niż w przypadku osobników pozbawionych tego źródła pożywienia. Lepszy jest też ich wzrost. Z drugiej strony konkurencja pomiędzy kijankami w podobnym wieku wpływa nań niekorzystnie. Koszty ewolucyjne także okazują się mniejsze, niż się to początkowo wydaje. Aga składa skrzek razem w kłębie, dojrzewają one też w podobnym okresie. Aga może złożyć jaja kolejny raz podczas jednego roku, ale odstęp wynosi około 74 dni, tak więc trwa on dłużej, niż stadium larwalne. Uniemożliwia to żerowanie na jajach tej samej matki, która dodatkowo rzadko rozmnaża się powtórnie w tym samym zbiorniku wodnym. Także ryzyko zarażenia się chorobą od dopiero co powstałego organizmu, chronionego osłonką żelową, jest niewielkie. Specyficzność w zjadaniu jaja własnego gatunku może tłumaczyć większa konkurencja z ropuszymi larwami, niż z kijankami innych płazów. Pozostałe stadia rozwojowe agi nie są zagrożone kanibalizmem[26].
Podobnie jak tempo wzrostu, również czas, w którym ropucha osiąga dojrzałość płciową, zależy od regionu. W Nowej Gwinei dojrzałość płciową osiągają samice o długości od pyska do otworu kloaki od 70 do 80 mm. Natomiast w Panamie stają się dojrzałe płciowo, mając od 90 do 100 mm długości[43]. W rejonach tropikalnych, jako ich naturalnych siedliskach, rozród odbywa się cały rok, zaś w rejonach podzwrotnikowych jedynie w cieplejszych okresach występujących z nadejściem pory deszczowej[44].
Pożywienie
Większość bezogonowych wykrywa swą zdobycz przede wszystkim za pomocą wzroku, reagując głównie na ruch ofiary. Wzrok wydaje się być również głównym zmysłem wykorzystywanym przez ropuchę agę. Potrafi ona także lokalizować swe pożywienie za pomocą węchu[45]. Jej pożywienie jest urozmaicone, zazwyczaj są to gryzonie, gady, inne płazy, ptaki i różne bezkręgowce[46], szczególnie mrówkowate, chrząszcze, także pająki, skorpiony, skolopendry[47]; a także rośliny, karma dla psów i odpady z domostw. Aga połyka swą zdobycz w całości[46].

Przystosowania ochronne
Skóra osobnika dorosłego jest toksyczna. Podobna cecha dotyczy powiększonych gruczołów przyusznych ulokowanych za oczami, a także innych gruczołów na plecach agi. Gruczoły przestraszonej ropuchy wydzielają mlecznobiały płyn, bufotoksynę[48]. Jej składniki są trujące dla wielu zwierząt[49]. Odnotowano nawet zgony ludzi po spożyciu ropuchy agi[33]. Wielu ludzi ulega także poważnym zatruciom po spożyciu skrzeku, który jest nagminnie mylony z kawiorem[5].
Bufotenina, jedna z substancji chemicznych wydzielanych przez agi, jest klasyfikowana przez australijskie prawo jako narkotyk klasy 1, razem z heroiną i konopiami. Uważa się, że efekty oddziaływania bufoteniny przypominają objawy łagodnego zatrucia: występuje pobudzenie z omamami, trwające mniej niż godzinę[50]. Aga wydziela jednak bufoteninę w niewielkich ilościach, inne toksyny natomiast w ilościach względnie większych. Lizanie ropuch może skutkować poważną chorobą, a nawet śmiercią[51].
Poza wytwarzaniem toksyny aga potrafi nadąć swe płuca; unosząc ciało nad podłoże wydaje się potencjalnemu drapieżnikowi wyższa i większa[48].
Toksyczne kiełbaski zawierające mięso ropuch testowano w Kimberley (Australia Zachodnia), by chronić rodzimą zwierzynę przed śmiertelnym niebezpieczeństwem wynikającym z inwazji ropuch. Western Australian Department of Environment and Conservation współpracowała z Uniwersytetem w Sydney w celu stworzenia przynęt mających za zadanie uczyć miejscowe zwierzęta, aby nie spożywały ropuch. Połączenie fragmentów ropuch ze środkiem emetogennym w jednej przynęcie uczy inne zwierzęta unikania tych płazów. Badacz David Pearson stwierdził, że badanie, które prowadzono w laboratorium i w odludnych miejscach okolicy Kimberley w Australii Zachodniej nie rozwiąże problemu całkowicie[52].
Drapieżnicy
Wiele drapieżników łowi agę w jej naturalnym środowisku. Zaliczają się do nich kajman szerokopyski, wąż Leptodeira annulata, węgorzowate, różne gatunki ryb karpieńcokształtnych[53], Kuhlia rupestris), pewne ryby sumokształtne, niektóre gatunki ibisów[53] i Paraponera clavata. Drapieżniki nie pochodzące z naturalnego regionu występowania agi to Haliastur sphenurus, bobroszczur złotobrzuchy, szczur śniady i waran paskowany. Istnieją doniesienia o okazjonalnym drapieżnictwie paszczaka australijskiego i papuaskiego[54]. W Australii 2 gatunki węży: Pseudechis porphyriacus i Dendrelaphis punctulatus przystosowały się do obecności agi wśród zdobyczy. Dzięki mniejszej głowie unikają połykania większej ilości toksyn, a większa masa ciała pozwala bardziej rozcieńczyć trującą substancję ropuchy. Zmiany te zaszły przez około 20 pokoleń węży, czyli około 60 lat[55]. Prawdopodobnie również oposy z rodzaju Didelphis mogą pożywiać się agą[56].
Rozmieszczenie geograficzne
Ropucha aga pochodzi z obu Ameryk. Jej zasięg występowania rozciąga się od Rio Grande Valley na południu Teksasu do środkowej Amazonii i południowego wschodu Peru[57][58]. Obszar ten obejmuje zarówno środowiska tropikalne, jak i półpustynne. Zagęszczenie osobników jest jednak w obrębie jej naturalnego zasięgu występowania znacznie mniejsze, niż w miejscach, gdzie została introdukowana. W Ameryce Południowej odnotowano zagęszczenie wynoszące 20 zwierząt na 100 metrów (109 jardów) linii brzegowej. W Australii obserwuje się ropuchy w ilościach 50–100 razy większych[59].
Introdukcje
Agę introdukowano w wielu rejonach świata, zwłaszcza na wyspach Pacyfiku. Działaniom tym przyświecał cel w postaci kontroli szkodników w rolnictwie[57], w większości były one dobrze dokumentowane. Ropucha ta należy w związku z powyższym do najlepiej opisanych przypadków introdukcji[60].
Przed początkiem lat 40. XIX wieku płaza introdukowano na Martynice i Barbadosie, z terenów od Gujany Francuskiej i Gujany[61]. W 1844 przeprowadzono przeniesienie zwierzęcia na Jamajkę w celu redukcji populacji szczurów[62]. Kontrola populacji gryzoni okazała się niepowodzeniem, mimo to agę introdukowano na Portoryko, mając nadzieję na przeciwdziałanie pladze chrząszczy niszczących plantacje trzcin cukrowej. Operacja okazała się udana, zatrzymując ekonomiczną zapaść spowodowaną inwazją chrząszczy. Skłoniła też badaczy z lat trzydziestych do uznania agi za idealne rozwiązanie problemów ze szkodnikami rolniczymi[63].
W efekcie liczne kraje regionu Pacyfiku zdecydowały się w latach trzydziestych powtórzyć program z Portoryko i wprowadzić na swym terytorium ropuchę[64]. Płaza introdukowano w Australii, na Florydzie[65], na Papui-Nowej Gwinei[66], Filipinach[67], wyspach Ogasawara, Ishigaki i Daitō w Japonii[68], Fidżi i wielu innych wyspach Pacyfiku[64], w tym na Hawajach[69][70], poza tym na większości Wysp Karaibskich[64]. Od tego czasu ropucha aga zdążyła stać się szkodnikiem w wielu krajach, wyrządzając poważne szkody w miejscowej faunie[71].
Karaiby
Agę wprowadzono na licznych wyspach karaibskich w celu kontroli szkodników niszczących uprawy[72]. Udało się to na niektórych wyspach, takich jak Barbados, Jamajka czy Portoryko. Natomiast inne introdukcje, m.in. na Kubie przed 1900 i w 1946, oraz na Dominice czy Wielkim Kajmanie, okazały się nieudane[73].
Najstarsza udokumentowana introdukcja dotyczyła Barbadosu i Martyniki. W przypadku Barbadosu skupiono się na biologicznej kontroli szkodników niszczących zbiory trzciny cukrowej[74]. Choć R. marina stała się bardzo pospolita, nie odniesiono sukcesu[75]. Przed 1844 na Martynikę z powodzeniem przeniesiono zwierzęta pochodzące z Gujany Francuskiej. Wedle danych z 2001 redukują one liczebność komarów i turkuciowatych[76]. Trzecia introdukcja na tym terenie miała miejsce w 1884. Zwierzęta pojawiły się na Jamajce, importowane z Barbadosu w celu kontroli populacji gryzoni. Nie stwierdzono znacznego efektu w przypadku populacji szczurów, niemniej agi przyjęły się dobrze[77]. Prawdopodobnie przed 1916 płazy wypuszczono na Antigui. Pojawiają się jednakże sugestie, że ta początkowa populacja wymarła do 1934, a agi zostały reintrodukowane później[78]. Na Montserrat ropuchy pojawiły się przed 1879, zakładając silną populację, która przetrwała erupcję wulkanu Soufrière Hills w 1995[79].
W 1920 płaza wprowadzono w Portoryko w celu kontroli Phyllophaga, szkodnika trzciny cukrowej[80]. Wcześniej szkodniki te zbierano ręcznie, wobec czego wypuszczenie ropuchy znacznie zmniejszyło koszty[80]. Drugą grupę osobników importowano w 1923, do 1932 ropucha się zadomowiła (po wynalezieniu skutecznej metody zabijania Phyllophaga za pomocą środków chemicznych argumenty dla używania ag w Portoryko ograniczyły się do niewielkich obszarów plantacji ananasów na wzgórzach, gdzie ropuchy nie osiągnęły jeszcze odpowiedniego zagęszczenia)[81]. Populacja Phyllophaga uległa dramatycznemu spadkowi[80], co przypisano adze na dorocznym spotkaniu International Sugar Cane Technologists w Portoryko[71]. Jednak mogły tu zadziałać i inne czynniki[71]. Sześcioletni okres po 1931, przypadający na bujny rozwój populacji agi i drastyczny spadek szkodnika, był także czasem największych w historii opadów deszczu w Portoryko[82]. Niemniej przypisano adze kontrolę populacji Phyllophaga, pogląd ten wzmocniła publikacja w Nature o tytule "Toads save sugar crop" ("Ropuchy ratują zbiory trzciny")[71]. Doprowadziło to do introdukcji na wielką skalę w wielu miejscach Pacyfiku[83].
Później agę napotkano na Carriacou i Dominice, w tym drugim przypadku pomimo niepowodzenia wcześniejszej introdukcji[84].
Australia
Widoczne sukcesy związane z pożeraniem przez agę chrząszczy na plantacjach trzciny cukrowej w Portoryko i owocne introdukcje na Hawajach oraz Filipinach pociągnęły za sobą żądania wprowadzenia gatunku w Australii w celu unieszkodliwienia szkodników niszczących plantacje trzciny cukrowej na polach Queensland[85]. W rezultacie odłowiono na Hawajach 102 osobniki, tyle samo samców i samic, które zabrano do Australii[86]. Po pierwotnym wypuszczeniu ropuch w sierpniu 1935 ministerstwo zdrowia podjęło decyzję o zablokowaniu przyszłych introdukcji przed przeprowadzeniem badań zwyczajów pokarmowych agi. Ukończono je w 1936 i zakaz zniesiono. Wtedy też podjęto serię wypuszczeń na wielką skalę. W marcu 1937 62000 ropuszek wypuszczono na wolność[87][86]. Płazy przyjęły się w Queensland dobrze, a ich liczebność wzrastała wykładniczo. Zasięg występowania rozszerzał się na Terytorium Północne i Nową Południową Walię[31][86]. W lipcu 2010 podano w mediach, że agi pojawiły się w Australii Zachodniej, a pojedynczego osobnika spotkano na dalekim zachodnim wybrzeżu, w okolicy Broome[88].
R. marina nie okazała się jednak skuteczna w tępieniu chrząszczy. Po części wiązało się to z tym, że plantacje trzcin nie zapewniały odpowiedniego schronienia dla drapieżników żerujących za dnia[89]. Natomiast od czasu swego wprowadzenia aga wywarła znaczący efekt na bioróżnorodność Australii. Zmniejszyła się ilość rodzimych drapieżnych gadów. Zalicza się do nich waranowate Varanus mertensi, V. mitchelli i V. panoptes, węże Pseudechis australis i zdradnicę śmiercionośną (Acanthophis antarcticus), a nawet krokodyla australijskiego (Crocodylus johnstoni). Z drugiej strony wzrosła ilość jaszczurek agamowatych Amphibolurus gilberti, stanowiących zdobycz V. panoptes[90][91].
Filipiny
Aga trafiła na Filipiny w latach trzydziestych XX wieku w wyniku świadomej introdukcji jako biologicznego środka kontroli szkodników plantacji trzciny cukrowej. Dokonano tego po sukcesie eksperymentalnego wprowadzenia zwierzęcia w Portoryko[93][94]. Stała się następnie najbardziej rozpowszechniona z płazów wysp. Zachowała nazwę zwyczajową kamprag w języku bisajskim, powstałą ze zniekształcenia "American frog" ("amerykańskiej żaba"), nazwy odwołującej się do pochodzenia płaza[92]. Popularnie w filipińskim angielskim nazywa się ją także "bullfrog" ("żaba-byk")[95].
Fidżi
Ropuchę wprowadzono na Fidżi w celu zwalczania owadów niszczących plantacje trzciny cukrowej. Introdukcję zasugerowano po raz pierwszy w 1933, opierając się na sukcesach portorykańskich i hawajskich. Po rozważeniu prawdopodobnych efektów ubocznych rząd Fidżi zdecydował się wypuścić płaza w 1953. 67 osobników importowano następnie z Hawajów[96]. Gdy się zadomowiły, badanie opublikowane w 1963 wykazało, że dieta ag obejmuje bezkręgowce zarówno szkodliwe, jak i pożyteczne. Efekt oceniono jako ekonomicznie neutralny[70]. W 2001 agi można było spotkać na wszystkich większych wyspach Fidżi, aczkolwiek wydają się one mniejsze, niż w innych rejonach[97].
Nowa Gwinea
Agę z powodzeniem wprowadzono na Nową Gwineę w celu kontroli larw zawisakowatych zjadających plony wilca ziemniaczanego[57]. Pierwsze wypuszczenie odbyło się w 1937. Użyto ropuch przywiezionych z wysp hawajskich. Drugi raz, jeszcze w tym samym roku, użyto zwierząt z kontynentu australijskiego. Istnieją dowody na trzecie wypuszczenie ropuch w 1938. Dotyczą one osobników używanych przez ludzi w testach ciążowych[98][99]. Wczesne raporty podawały, że ropuchy cechowały się dużą efektywnością w redukcji gąsienic. Zasugerowano, że plony wilca ziemniaczanego się poprawiają[100]. W efekcie te pierwsze wypuszczenia zostały ponowione w większej części regionu[100], choć ich efektywność w przypadku innych plonów, jak kapusta, była kwestionowana. Gdy ropuchy wypuszczono w Wau, kapusta okazała się dla nich niedostatecznym schronieniem, dlatego szybko opuściły te tereny, poszukując lepszego schronienia w lasach[101]. Podobna sytuacja miała miejsce poprzednio na australijskich polach trzciny cukrowej, ale informacja ta była nieznana lub ignorowana w Nowej Gwinei[101]. Od tamtego czasu aga licznie występowała na terenach wiejskich i miejskich[102].
USA
Aga występuje naturalnie w południowym Teksasie. Przeprowadzono jednak działania, zarówno umyślne, jak i przypadkowe, które doprowadziły do introdukcji gatunku w innych częściach kraju. Płaza wprowadzono na kontynentalną Florydę i na Hawaje. Introdukcje w Luizjanie w większości nie przyniosły sukcesu[103].
Początkowe wypuszczenia osobników na Florydzie skończyły się niepowodzeniem. Introdukcje przed 1936 i 1944, mające na uwadze kontrolę szkodników trzciny cukrowej, były bezowocne, ponieważ ropuchy nie rozmnażały się. Późniejsze próby zawiodły w podobny sposób[104][105]. Ropuchy zadomowiły się w tym stanie dopiero po przypadkowym wypuszczeniu przez importera na terenie portu lotniczego Miami w 1957 i umyślnych wypuszczeniach przez sprzedawców zwierząt w 1963 i 1964, opanowując inne regiony Florydy[105][106]. W 2001 ropucha zajmowała obszar od Florida Keys do północy Tampa. Stopniowo zasięg gatunku posuwa się w kierunku północnym[107]. Aga zagraża rodzimym gatunkom Florydy[108] i zwierzętom domowym[109]. W związku z tym Florida Fish and Wildlife Conservation Commission rekomenduje usypianie jej przez mieszkańców[110].
Około 150 osobników wprowadzono na hawajską wyspę Oʻahu w 1932. Po 17 miesiącach populacja wynosiła 105517 ag[64]. Ropuchy wysyłano na inne wyspy. Ponad 100 tysięcy ropuch rozprowadzono w lipcu 1934[111]. Ostatecznie przetransportowano ponad 600 tysięcy osobników[112].
Wykorzystanie
Prócz poprzednio opisanych prób użycia ropuchy agi w celu biologicznej kontroli szkodników płazy te bywały wykorzystywane do rozmaitych celów komercyjnych i innych. Tradycyjnie na obszarze ich naturalnego występowania w Ameryce Południowej Emberá-Wounaan otrzymują z ropuch toksynę używaną do zatruwania strzał. Istnieją także sugestie, że Olmekowie wykorzystywali toksyny agi jako enteogen. Ropuchę chwytano jako źródło pożywienia w niektórych częściach Peru. Spożywano je po oddzieleniu skóry i parotydów[113]. Bardziej współcześnie toksyny ropuch używane są na liczne sposoby, w Japonii używa się bufoteniny jako afrodyzjaka i środka przeciwko łysieniu, w Chinach ma zastosowanie w kardiochirurgii do obniżania ilości uderzeń serca[33].
Ropuchy agi używano w procesie przeprowadzania testów ciążowych[113], wykorzystywane są też jako zwierzę domowe[114], laboratoryjne[115], a także do produkcji wyrobów skórzanych. Testy ciążowe w połowie XX wieku przeprowadzano, wstrzykując mocz kobiet ciężarnych do zbiorników układu limfatycznego samców ropuch. Jeśli w moczu płaza obecne były plemniki, pacjentkę uznawano za ciężarną[113]. Testy z użyciem ropuch były szybsze od tych z wykorzystaniem ssaków: ropuchy łatwiej rosły, a od odkrycia możliwości zastosowania Bufo arenarum w 1948 stało się jasne, że wiele różnych gatunków płazów jest odpowiednich do testu, w tym ropucha aga. W rezultacie ropuch używano w tym celu około 20 lat[57]. Aga jest też idealna do celów laboratoryjnych, łatwa i tania w hodowli. Eksperymenty na tym gatunku rozpoczęto w latach 50. i do końca lat 60. wiele osobników odłowiono i wyeksportowano do szkół wyższych czy uniwersytetów[115]. Od tego czasu liczne stany Australii wprowadziły bądź zaostrzyły przepisy regulujące import[116]. Nawet martwe agi posiadają pewną wartość. Ich skóra służy do wyrobu materiałów skórzanych[117][118]. Wypchane agi znalazły się w wielu sklepach turystycznych[119]. Starano się również wyprodukować z nich nawóz[120].
Przypisy
- ↑ Rhinella marina, [w:] Integrated Taxonomic Information System [online] (ang.).
- ↑ a b c d e f g h i j k l Jiménez-Uzcátegui 2012 ↓, s. 1.
- ↑ Rhinella marina, [w:] The IUCN Red List of Threatened Species [online] (ang.).
- ↑ Darrel Frost and The American Museum of Natural History: Rhinella marina. Amphibian Species of the World 5.2, an Online Reference. [dostęp 2009-02-19]. (ang.).
- ↑ a b Bernhard Grzimek: Grzimek's Animal Life Encyclopedia. Vol. 6: Amphibians, 2nd Edition. Thomson Gale, 2004.
- ↑ Estes, Richard & Richard Wassersurg. A Miocene toad from Colombia, South America. „Breviora”. 193, s. 1-13, 1963-12-05. (ang.).
- ↑ George R. Zug, Patricia B. Zug. The Marine Toad, Bufo marinu: A Natural History Resume of Native Populations. „Smithsonian Contributions to Zoology”. 284, 1979. (ang.).
- ↑ Linnaeus 1758 ↓, s. 824.
- ↑ Beltz 2007 ↓.
- ↑ Easteal i in. 1985 ↓, s. 185.
- ↑ Cane Toad (Bufo marinus). [w:] National Invasive Species Information Center [on-line]. United States Department of Agriculture, 15 czerwca 2009. [dostęp 2009-06-17].
- ↑ Caughley i Gunn 1996 ↓, s. 140.
- ↑ Australian State of the Environment Committee 2002 ↓, s. 107.
- ↑ Kenny 2008 ↓, s. 35.
- ↑ a b Frost, Darrel R. American Museum of Natural History, New York, USA.: Amphibian Species of the World: an Online Reference. Version 5.5. 2011-01-31. [dostęp 2012-06-04].
- ↑ Around the world in 10 million years: biogeography of the nearly cosmopolitan true toads (Anura: Bufonidae). „Global Ecology and Biogeography”. 17. s. 76. DOI: 10.1111/j.1466-8238.2007.00348.x.
- ↑ Frank Solís i inni, Rhinella marina, [w:] The IUCN Red List of Threatened Species [online] [dostęp 2012-06-04] (ang.).
- ↑ Rhinella marina. Encyclopaedia of Life. [dostęp 2012-06-04].
- ↑ a b c d e f g h Natan Medeiros Maciel, Rosane Garcia Collevatti, Guarino Rinaldi Colli & Elisabeth Ferroni Schwartz. Late Miocene diversification and phylogenetic relationships of the huge toads in the Rhinella marina (Linnaeus, 1758) species group (Anura: Bufonidae). „Molecular Phylogenetics and Evolution”. 57, s. 787–797, 2010. Elsevier. DOI: 10.1016/j.ympev.2010.08.025. PMCID: PMC20813190. (ang.).
- ↑ a b Vanderduys i Wilson 2000 ↓, s. 1.
- ↑ a b Giant Burrowing Frog. [w:] Wildlife of Sydney [on-line]. Australian Museum, 2009-04-15. [dostęp 2015-07-14].
- ↑ Barker, Grigg i Tyler 1995 ↓, s. 381.
- ↑ Brandt i Mazzotti 2005 ↓, s. 3.
- ↑ a b c d e f Robinson 1998 ↓.
- ↑ Lee 2001 ↓, s. 928.
- ↑ a b c d Michael R. Crossland, Mark N. Hearnden, Ligia Pizzatto, Ross A. Alford & Richard Shine. Why be a cannibal? The benefits to cane toad, Rhinella marina (=Bufo marinus), tadpoles of consuming conspecific eggs. „Animal Behaviour”. 82, s. 775e782, 2011. Elsevier. DOI: 10.1016/j.anbehav.2011.07.009. (ang.).
- ↑ Wyse 1997 ↓, s. 249.
- ↑ a b c Tyler 1989 ↓, s. 117.
- ↑ Tyler 1989 ↓, s. 117–118.
- ↑ Grenard 2007 ↓, s. 55.
- ↑ a b c Cameron 2009 ↓.
- ↑ Tyler 1976 ↓, s. 81.
- ↑ a b c d Invasive Species Specialist Group 2006 ↓.
- ↑ a b c d e f Tyler 1989 ↓, s. 116.
- ↑ Ely 1944 ↓, s. 256.
- ↑ Lever 2001 ↓, s. 3.
- ↑ Barker, Grigg i Tyler 1995 ↓, s. 380.
- ↑ Tyler 1989 ↓, s. 118.
- ↑ a b Tyler 1989 ↓, s. 119.
- ↑ Zug i Zug 1979 ↓, s. 14–15.
- ↑ Zug i Zug 1979 ↓, s. 15.
- ↑ Anstis 2002 ↓, s. 274.
- ↑ Zug i Zug 1979 ↓, s. 8.
- ↑ Lever 2001 ↓, s. 6.
- ↑ Lever 2001 ↓, s. 10.
- ↑ a b Tyler 1989 ↓, s. 130–132.
- ↑ Werren, G. L.; Trenerry, M. P.. Size and diet of Bufo marinus in rainforest of northeastern Queensland. „Memoirs of the Queensland Museum”. 34, s. 240, 1993. (ang.).
- ↑ a b Tyler 1989 ↓, s. 134.
- ↑ Tyler 1989 ↓, s. 134–136.
- ↑ Fawcett 2004 ↓, s. 9.
- ↑ Weil i Davis 1994 ↓, s. 1–8.
- ↑ Cane toad sausages. abc.net.au. [dostęp 2011-11-15]. (ang.).
- ↑ a b Tyler 1989 ↓, s. 138–139.
- ↑ Angus 1994 ↓, s. 10–11.
- ↑ Nils OL Carlsson, Orlando Sarnelle & David L Strayer. Native predators and exotic prey – an acquired taste?. „Front Ecol Environ”. 7, s. 525–532, 2009. DOI: 10.1890/080093. [zarchiwizowane z adresu]. (ang.).
- ↑ American possums the solution to cane toads in Australia? – Science Show – 20 marca 2010. Abc.net.au. [dostęp 2010-04-26]. [zarchiwizowane z tego adresu (2010-03-22)]. (ang.).
- ↑ a b c d Tyler 1989 ↓, s. 111.
- ↑ Zug i Zug 1979 ↓, s. 1–2.
- ↑ Lampo i De Leo 1998 ↓, s. 392.
- ↑ Easteal 1981 ↓, s. 94.
- ↑ Easteal 1981 ↓, s. 96.
- ↑ Lannoo 2005 ↓, s. 417.
- ↑ Tyler 1989 ↓, s. 112–113.
- ↑ a b c d Tyler 1989 ↓, s. 113–114.
- ↑ Smith 2005 ↓, s. 433–441.
- ↑ Zug, Lindgrem i Pippet 1975 ↓, s. 31–50.
- ↑ Alcala 1957 ↓, s. 90–96.
- ↑ Kidera i in. 2008 ↓, s. 423–440.
- ↑ Oliver i Shaw 1953 ↓, s. 65–95.
- ↑ a b Hinckley 1963 ↓, s. 253–259.
- ↑ a b c d Tyler 1989 ↓, s. 113.
- ↑ Lever 2001 ↓, s. 67.
- ↑ Lever 2001 ↓, s. 73–74.
- ↑ Lever 2001 ↓, s. 71.
- ↑ Kennedy, Anthony za Lever 2001 ↓, s. 72
- ↑ Lever 2001 ↓, s. 81.
- ↑ Lever 2001 ↓, s. 78–79.
- ↑ Easteal 1981 ↓, s. 98.
- ↑ Lever 2001 ↓, s. 81–82.
- ↑ a b c Tyler 1989 ↓, s. 112.
- ↑ Van Volkenberg 1935 ↓, s. 278–279.
- ↑ Freeland 1985 ↓, s. 211–215.
- ↑ Tyler 1989 ↓, s. 113–115.
- ↑ Lever 2001 ↓, s. 72–73.
- ↑ Tyler 1976 ↓, s. 77.
- ↑ a b c Easteal 1981 ↓, s. 104.
- ↑ Tyler 1976 ↓, s. 78–79.
- ↑ Cane toads found on WA coast. Australian Geographic, 21 lipca 2010. [dostęp 2016-10-09].
- ↑ Tyler 1976 ↓, s. 83.
- ↑ Doody i in. 2009 ↓, s. 46–53.
- ↑ Shine 2009 ↓, s. 20.
- ↑ a b kamprag. Binisaya.com.
- ↑ Ross Piper: Pests: A Guide to the World's Most Maligned, Yet Misunderstood Creatures. ABC-CLIO, 2011, s. 236. ISBN 978-0-313-38426-4.
- ↑ Arvin C. Diesmos, Mae L. Diesmos, & Rafe M. Brown. Status and Distribution of Alien Invasive Frogs in the Philippines. „Journal of Environmental Science and Management”. 9 (2), s. 41–53, 2005. ISSN 0119-1144.
- ↑ Ranell Martin M. Dedicatoria, Carmelita M. Rebancos, Leticia E. Afuang and Ma. Victoria O. Espaldon. Identifying Environmental Changes in Mt. Data Watershed, Bauko, Mt. Province, Northern Philippines: Implications to Sustainable Management. „4th Asian Rural Sociology Association (ARSA) International Conference”, s. 402–412, 2010.
- ↑ Lever 2001 ↓, s. 128–129.
- ↑ Lever 2001 ↓, s. 130–131.
- ↑ Easteal 1981 ↓, s. 103.
- ↑ Tyler, Wassersug i Smith 2007 ↓, s. 6–7.
- ↑ a b Lever 2001 ↓, s. 118.
- ↑ a b Tyler 1976 ↓, s. 83–84.
- ↑ Lever 2001 ↓, s. 119.
- ↑ Easteal 1981 ↓, s. 100–102.
- ↑ Lever 2001 ↓, s. 57.
- ↑ a b Easteal 1981 ↓, s. 100.
- ↑ Lever 2001 ↓, s. 58.
- ↑ Lever 2001 ↓, s. 59.
- ↑ Bufo Marinus @ Florida Wildlife Extension at UF/IFAS. Wec.ufl.edu. [dostęp 2015-07-14].
- ↑ Poisonous Bufo May Have Toad Hold On Temple Terrace. .tbo.com, 2 listopada 2007. [dostęp 2010-04-26]. [zarchiwizowane z tego adresu (2015-07-15)].
- ↑ WEC 11/UW046: Marine Toads (Bufo marinus). Edis.ifas.ufl.edu. [dostęp 2010-04-26].
- ↑ Lever 2001 ↓, s. 64.
- ↑ Easteal 1981 ↓, s. 101.
- ↑ a b c Lever 2001 ↓, s. 32.
- ↑ Mattison 1987 ↓, s. 145.
- ↑ a b Tyler 1976 ↓, s. 85.
- ↑ Tyler 1976 ↓, s. 88–89.
- ↑ McCarin 2008 ↓, s. 8.
- ↑ Hardie 2001 ↓, s. 3.
- ↑ Bateman 2008 ↓, s. 48.
- ↑ Australian Associated Press 2006 ↓.
Bibliografia
- A. C. Alcala. Philippine notes on the ecology of the giant marine toad. „Silliman Journal”. 4 (2), 1957.
- R. Angus. Observation of a Papuan Frogmouth at Cape York [Queensland]. „Australian Birds”. 28, 1994.
- M. Anstis: Tadpoles of South-Eastern Australia: A Guide with Keys. Reed New Holland, 2002. ISBN 1-876334-63-0.
- Australian Associated Press. Toads to be juiced. „Sydney Morning Herald”, 2006-01-26. [dostęp 2015-07-14].Sprawdź autora:1.
- Australian State of the Environment Committee: Biodiversity. Australia: CSIRO Publishing, 2002. ISBN 0-643-06749-3.Sprawdź autora:1.
- John Barker, Gordon Grigg, Michael Tyler: A Field Guide to Australian Frogs. Surrey Beatty & Sons, 1995. ISBN 0-949324-61-2.
- Daniel Bateman. Toad business the stuff of dreams. „Townsville Bulletin”, 2008-05-10.
- Ellin Beltz: Scientific and Common Names of the Reptiles and Amphibians of North America. 2007-09-10. [dostęp 2015-07-14].
- Laura A. Brandt, Frank J. Mazzotti: Marine Toads (Bufo marinus). University of Florida, 2005.
- Elizabeth Cameron: Cane Toad. [w:] Wildlife of Sydney [on-line]. Australian Museum, 2009-06-10. [dostęp 2015-07-14].
- Graeme Caughley, Anne Gunn: Conservation biology in theory and practice. Wiley-Blackwell, 1996. ISBN 0-86542-431-4.
- Michael R. Crossland, Ross A. Alford, Richard Shine. Impact of the invasive cane toad (Bufo marinus) on an Australian frog (Opisthodon ornatus) depends on minor variation in reproductive timing. „Population Ecology”. 158 (4), s. 625, 2009. DOI: 10.1007/s00442-008-1167-y.
- J.S. Doody i inni, Population-level declines in Australian predators caused by an invasive species, R. Sims, T. Robinson, „Animal Conservation”, 1, 12, 2009.
- Simon Easteal. The history of introductions of Bufo marinus (Amphibia : Anura); a natural experiment in evolution. „Biological Journal of the Linnean Society”, 1981.
- Simon Easteal, Eric K. van Beurden, Robert B. Floyd, Michael D. Sabath. Continuing Geographical Spread of Bufo marinus in Australia: Range Expansion between 1974 and 1980. „Journal of Herpetology”. 19 (2), 1985-06.
- C. A. Ely. Development of Bufo marinus larvae in dilute sea water. „Copeia”. 56 (4), s. 256, 1944. DOI: 10.2307/1438692. JSTOR: 1438692.
- Anne Fawcett. Really caning it. „The Sydney Morning Herald”, s. 9, 2004-08-04.
- W. J. Freeland. The Need to Control Cane Toads. „Search”. 16 (7–8), s. 211–215, 1985.
- Steve Grenard: Frogs and Toads. John Wiley and Sons, 2007. ISBN 0-470-16510-3.
- Alan Hardie. It's tough selling toads .... „Northern Territory News”, 2001-01-22.
- A. D. Hinckley. Diet of the giant toad, Budo marinus (L.) in Fiji. „Herpetologica”. 18 (4), 1963.
- Invasive Species Specialist Group: Ecology of Bufo marinus. [w:] Global Invasive Species Database [on-line]. 2006-06-01. [dostęp 2015-07-14].Sprawdź autora:1.
- Gustavo Jiménez-Uzcátegui, Cruz Márquez, Howard L. Snell. CDF Checklist of Galapagos Amphibians. „W: Bungartz, F., Herrera, H., Jaramillo, P., Tirado, N., Jiménez-Uzcátegui, G., Ruiz, D., Guézou, A. Ziemmeck, F. (eds.). Charles Darwin Foundation Galapagos Species Checklist – Lista de Especies de Galápagos de la Fundación Charles Darwin.”, 2012-06-21. Charles Darwin Foundation. [zarchiwizowane z adresu]. (ang.).
- Julian Kenny: The Biological Diversity of Trinidad and Tobago: A Naturalist's Notes. Prospect Press, 2008. ISBN 976-95082-3-3.
- N. Kidera i inni, Dietary habits of the introduced cane toad ''Bufo marinus'' (Amphibia : Bufonidae) on Ishigakijima, southern Ryukyus, Japan, A. Satoh i inni, „Pacific Science”, 62 (3), 2008.
- Margarita Lampo, Giulio A. De Leo. The Invasion Ecology of the Toad Bufo marinus: from South America to Australia. „Ecological Applications”. 8 (2), 1998.
- Michael J. Lannoo: Amphibian Declines: The Conservation Status of United States Species. University of California Press, 2005. ISBN 0-520-23592-4.
- Julian C. Lee. Evolution of a Secondary Sexual Dimorphism in the Toad, Bufo marinus. „Copeia”. 2001 (4), s. 928–935, 2001. DOI: [0928:EOASSD2.0.CO;2 10.1643/0045-8511(2001)001[0928:EOASSD]2.0.CO;2].
- Christopher Lever: The Cane Toad. The history and ecology of a successful colonist. Westbury Publishing, 2001. ISBN 1-84103-006-6.
- Carolus Linnaeus: Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Tomus I. Editio decima, reformata.. Holmiae. (Laurentii Salvii), 1758.
- Chris Mattison: Frogs & Toads of the World. Blandford Press, 1987. ISBN 0-7137-1825-0.
- Julie McCarin. Kisses for a toad. „The Leader”, 2008-04-29.
- J. A. Oliver, C. E. Shaw. The amphibians and reptiles of the Hawaiian Islands. „Zoologica (New York)”. 38 (5), 1953.
- Martyn Robinson: A field guide to frogs of Australia: from Port Augusta to Fraser Island including Tasmania. Reed New Holland, 1998. ISBN 1-876334-83-5.
- Rick Shine. Controlling Cane Toads Ecologically. „Australasian Science”. 30 (6), s. 20–23, 2009-06.
- K. G. Smith. Effects of nonindigenous tadpoles on native tadpoles in Florida: evidence of competition. „Biological Conservation”. 123 (4), 2005.
- Solis, Frank; Ibáñez, Roberto; Hammerson, Geoffrey; Hedges, Blair; Diesmos, Arvin; Matsui, Masafumi; Hero, Jean-Marc; Richards, Stephen; Coloma, Luis A.; Ron, Santiago; La Marca, Enrique; Hardy, Jerry; Powell, Robert; Bolaños, Federico; Chaves, GerardoFrank Solís i inni, Rhinella marina, [w:] The IUCN Red List of Threatened Species [online] [dostęp 2009-06-15] (ang.).
- Michael J. Tyler: Frogs. William Collins (Australia), 1976. ISBN 0-00-211442-9.
- Michael J. Tyler: Australian Frogs. Penguin Books, 1989. ISBN 0-670-90123-7.
- Michael J. Tyler, Richard Wassersug, Benjamin Smith. How frogs and humans interact: Influences beyond habitat destruction, epidemics and global warming. „Applied Herpetology”. 4 (1), s. 1, 2007. DOI: 10.1163/157075407779766741.
- Eric Vanderduys, Steve Wilson: Cane Toads (Fact Sheet). Queensland Museum, 2000.
- H. L. Van Volkenberg. Biological Control of an Insect Pest by a Toad. „Science”. 82 (2125), s. 278–9, 1935. DOI: 10.1126/science.82.2125.278. PMID: 17792964.
- A. T. Weil, W. Davis. Bufo alvarius: a potent hallucinogen of animal origin.. „Journal of Ethnopharmacology”. 41 (1–2), s. 1–8, 1994. DOI: 10.1016/0378-8741(94)90051-5. PMID: 8170151.
- E. (editor) Wyse: Guinness Book of Records 1998. Guinness Publishing, 1997. ISBN 0-85112-044-X.
- G. R. Zug, E. Lindgrem, J. R. Pippet. Distribution and ecology of marine toad, Bufo marinus, in Papua New Guinea. „Pacific Science”. 29 (1), 1975.
- G. R. Zug, P. B. Zug. The Marine Toad, Bufo marinus: A natural history resumé of native populations. „Smithsonian Contributions to Zoology”. 284, 1979.
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
Autor: Obsidian Soul, Licencja: CC0
Rhinella marina, Cane Toad from the Philippines. An invasive species locally known as American Frog.
Autor: Created by LiquidGhoul, ammended by Tnarg 12345, Licencja: CC-BY-SA-3.0
Distribution of Rhinella marinus, native distribution in blue, introduced in red.
(c) Froggydarb z angielskojęzycznej Wikipedii, CC-BY-SA-3.0
The range of the Cane Toad (Bufo marinus) in Australia.
Autor: Eli Greenbaum, Licencja: CC BY-SA 2.5
Bufo marinus, Parque Nacional El Imposible, La Fincona, 800 m, Ahuachapan (El Salvador)
Autor: Bidgee, Licencja: CC BY 3.0
A young Bufo marinus (Cane Toad). Darwin, Northern Territory.














