Anaplazmoza
| ||
| ICD-10 | A79.8 | |
| MeSH | D016873 | |
Anaplazmoza (łac. anaplasmosis), ludzka anaplazmoza granulocytarna (ang. human granulocytic anaplasmosis, HGA), dawniej określana jako ludzka granulocytarna ehrlichioza (ang. human granulocytic ehrlichiosis, HGE), odkleszczowa choroba zakaźna wywoływana przez bakterie Gram-ujemne Anaplasma phagocytophilum.
Epidemiologia
Po raz pierwszy ludzką anaplazmozę granulocytarną zidentyfikowano na początku lat 90. XX w. u pacjenta z Wisconsin (USA), u którego na skutek ukąszenia przez kleszcza wystąpiła ostra reakcja gorączkowa.
Zasięg geograficzny A. phagocytophilum obejmuje obszary Ameryki Północnej, Europy i Azji. Tak szerokie rozpowszechnienie może mieć związek z rozprzestrzenianiem się drobnoustroju dzięki ptakom przenoszącym na duże odległości zakażone kleszcze. Jednocześnie wspólny rezerwuar i wektor powoduje, iż HGA często współwystępuje na tych samych terenach endemicznych co borelioza z Lyme, babeszjoza i kleszczowe zapalenie mózgu.
Transstadialne utrzymywanie się drobnoustroju w organizmie kleszcza, pozwalające na szersze rozprzestrzenianie się w środowisku, oznacza konieczność infekowania kręgowców, będących źródłem zakażenia kolejnych pokoleń kleszczy. Za główny rezerwuar A. phagocytophilum uważa się więc dzikie zwierzęta kopytne (jelenie, sarny itp.) oraz gryzonie (myszy, ryjówki, nornice), przy czym rolę tę mogą odgrywać także owce. Z kolei konie, kozy, psy (jak również ludzie) prawdopodobnie zakażane są przypadkowo i nie ma to związku z dalszym rozprzestrzenianiem się infekcji.
W Europie do końca 2004 roku stwierdzono 22 przypadki zachorowań.
W Polsce według statystyk EPIMELD prowadzonych przez PZH od 1996 do 15.10.2011 zanotowano 7 przypadków zachorowań (1 w 1997, 1 w 2000, 1 w 2003, 1 w 2009, 3 w 2011 do 15 października). PZH umieścił jednostkę chorobowa w kategorii: Gorączka plamista i inne riketsjozy (A77, A79). Przed 1996 była to kategoria dur plamisty i inne riketsjozy. Przypuszczalnie choroba jest niedodiagnozowana ze względu na nieznajomość jej przez lekarzy, niespecyficzne objawy oraz niewielką ilość laboratoriów diagnostycznych wykonujących badania w kierunku wykrycia tego mikroorganizmu.
Etiologia
Anaplazmozę wywołuje mała Gram-ujemna bakteria (0,2-1 μm) Anaplasma phagocytophilum. Gatunek Anaplasma phagocytophilum dawniej zwana Ehlrlichia phagocytophila należy do rodzaju Anaplasma. Do tego rodzaju zaliczamy również gatunki: Anaplasma centrale, Anaplasma marginale, Anaplasma ovis. Rodzaj Anaplasma obok rodzajów Ehrilichia i Neorickettsia, stanowiących czynniki etiologiczne ostrych, odzwierzęcych chorób zakaźnych, należą do rodziny Anaplasmataceae. Do tej rodziny niektóre opracowania zaliczają również rodzaje Aegyptianella i Cowdria. Rodzaj Neorickettsia dzieli się na gatunki: Neorickettsia risticii, Neorickettsia sennetsu. Wśród rodzaju Ehrlichia wyróżniamy gatunki Ehrlichia canis, Ehrlichia chaffeensis, Ehrlichia ruminantium. Gatunek Ehrlichia chaffeensis wywołuje ludzką erlichiozę monocytarną przebiegającą w zbliżony sposób co ludzka anaplazmoza granulocytarna.
Do zakażenia najczęściej dochodzi w wyniku transmisji A. phagocytophilum po ukłuciu zainfekowanego kleszcza z rodzaju Ixodes (I. ricinus, I. pacificus, I. scapularis, I. persulcatus).
Anaplasma phagocytophilum należy do obligatoryjnych, wewnątrzkomórkowych patogenów atakujących wielojądrzaste leukocyty krwi, stąd też głównym miejscem jej bytowania w zakażonym organizmie są neutrofile. Drobnoustrój ten wiąże się do fukozylowanych lub sjalowanych białek występujących na powierzchni granulocytów – skuteczną adhezję do komórek zapewnia m.in. białko Msp2, które łącząc się z odpowiednim ligandem, tj. cząsteczką PSGL-1 (CD162), ułatwia tym samym przedostanie się bakterii na drodze endocytozy do wnętrza granulocytów. Następnie, unikając zniszczenia przez mechanizmy obronne gospodarza, bakterie namnażają się w obrębie powstałych wakuoli, skąd czerpią niezbędne do życia substancje odżywcze, tworząc charakterystyczne skupiska tzw. morule, z których ostatecznie zostają ponownie uwolnione do krwi.
Możliwość przeżycia wewnątrz komórek gospodarza A. phagocytophilum zawdzięcza zdolnościom upośledzania normalnego funkcjonowania neutrofilów, a więc każdego z etapów procesu fagocytozy (adhezji do komórek śródbłonka, diapedezy, chemotaksji, degranulacji, zakwaszenia fagosomu i powstania fagolizosomu, wybuchu tlenowego) i niszczenia drobnoustrojów. Ponadto zakażenie A. phagocytophilum w warunkach in vitro hamuje podziały komórkowe i zwiększa prawdopodobieństwo wejścia leukocytów na drogę prowadzącą do apoptozy.
Z kolei zaburzona synteza cytokin może być przyczyną nieprawidłowości hematologicznych i immunologicznych pojawiających się w czasie infekcji. Zaskakującym jest fakt, iż komórki zakażone A. phagocytophilum reagują intensywnym wydzielaniem chemokin o działaniu chemotaktycznym i hamującym hemopoezę (IL-8, MIP-1α, MCP-1), jednocześnie nie syntetyzując najważniejszych cytokin prozapalnych – IL-1 i TNF-α. W ten sposób uwalniane przez zakażone komórki szpiku chemokiny mogą wywierać miejscowo silny efekt mielosupresyjny, a zwiększony napływ leukocytów do miejsc infekcji ułatwia bakteriom zakażanie kolejnych komórek gospodarza.
Objawy kliniczne i przebieg
Przebieg HGA i nasilenie objawów jest niecharakterystyczny i zmienny – począwszy od infekcji bezobjawowej, kończąc na bardzo ciężkim, zagrażającym życiu zakażeniu.
Po przedostaniu się do wnętrza organizmu A. phagocytophilum rozprzestrzenia się drogą naczyń krwionośnych i chłonnych, atakując komórki układu krwiotwórczego i siateczkowo-śródbłonkowego (możliwe jest wykrycie bakterii we krwi obwodowej, zatokach brzeżnych śledziony, węzłach chłonnych, nerkach, płynie mózgowo-rdzeniowym, płucach). Następnie na skutek rozpadu komórek dochodzi do uwolnienia się drobnoustrojów do krwi i wtórnego zakażenia wielu narządów i tkanek.
Z reguły HGA ma łagodny i samoograniczający przebieg. Po okresie inkubacji, trwającym 1-60 dni (najczęściej 7-10), u większości chorych pojawiają się nieswoiste objawy ostrej infekcji obejmujące wysoką gorączkę (>39 ºC), dreszcze, bóle głowy, mięśni i stawów, nadmierne pocenie się, a także ogólne osłabienie i utratę apetytu. Zajęcie układu oddechowego manifestuje się suchym kaszlem oraz atypowym zapaleniem płuc, naciekami płucnymi i zaburzeniami oddychania. Z kolei łagodnie przebiegające zmiany skórne pod postacią wysypki, nie będącej typowym objawem HGA, mogą wskazywać na współistnienie innej infekcji. Zaburzenia żołądkowo-jelitowe – mdłości, wymioty, biegunka, bóle brzucha również należą do objawów związanych z zakażeniem A. phagocytophilum. Ponadto w przebiegu choroby może dojść do splenomegalii oraz powiększenia wątroby i związanej z nim martwicy hepatocytów i cholestazy wewnątrzwątrobowej, natomiast w wielu innych narządach m.in. nerkach, sercu, oponach mózgowych czy płucach, obserwuje się liczne okołonaczyniowe nacieki limfocytarne. Ponieważ zakażeniu ulegają nie tylko leukocyty krwi obwodowej, ale także szpik kostny u części chorych infekcja prowadzi do hipoplazji i wystąpienia zmian o charakterze ziarniniaków; jednocześnie skutkiem zajęcia megakariocytów szpiku może być rozwój typowej dla przebiegu HGA trombocytopenii. Zdarza się, że pacjenci wykazują nasilone objawy neurologiczne w postaci zaburzeń świadomości i niedowładów, wskazujące na zapalenie opon mózgowo-rdzeniowych.
Choć objawy kliniczne HGA ustępują najczęściej samoistnie w ciągu kilku dni, to jednak w przypadku braku odpowiedniego leczenia u niewielkiego odsetka chorych mogą wystąpić ciężkie powikłania zagrażające ich życiu, takie jak: niewydolność nerek, zespół ostrej niewydolności oddechowej, rozpad mięśni prążkowanych, zapalenie mięśnia sercowego i wysięk osierdziowy. Często obserwuje się także zawroty głowy, jedno-/dwustronne porażenie twarzy, neuropatię obwodową czy bóle splotów płucnych. Spadek ilości płytek krwi, a tym samym zaburzenia krzepnięcia przebiegające w postaci plamicy małopłytkowej z towarzyszącą anemią hemolityczną, pociąga za sobą ryzyko wystąpienia krwawień np. do światła przewodu pokarmowego, a także krwotoków (opisano przypadek krwotoku podtwardówkowego). Ze względu na ciężkie powikłania HGA związane często z rozwojem oportunistycznych zakażeń grzybiczych i wirusowych – zapalenie płuc spowodowane przez Candida albicans i Cryptococcus neoformans czy zapalenie i krwotok z górnego odcinka przewodu pokarmowego wywołane infekcją Herpes simplex i C. albicans – a także wcześnie ujawniający się zespół rozsianego wykrzepiania wewnątrznaczyniowego, śmiertelność wśród osób zakażonych sięga do 5%.
W przypadku zakażenia A. phagocytophilum może dochodzić do reinfekcji, natomiast nie wiadomo do końca czy możliwe jest aby HGA przybierała postać przewlekłą.
Rozpoznanie
Z powodu braku charakterystycznego obrazu klinicznego i możliwości występowania koinfekcji innymi chorobotwórczymi czynnikami odkleszczowymi, właściwe rozpoznanie HGA przysparza wiele trudności. Stąd identyfikacja i potwierdzenie zakażeń spowodowanych przez A. phagocytophilum wymaga starannego wywiadu epidemiologicznego i przeprowadzenia dokładnych badań diagnostycznych potwierdzających wstępne podejrzenie choroby.
We wczesnym etapie choroby w badaniach laboratoryjnych często stwierdza się wspomnianą wcześniej trombocytopenię, limfopenię oraz leukopenię, której towarzyszy zwiększony odsetek i odmłodzenie obrazu granulocytów krwi obwodowej wskazujące na zakażenie bakteryjne. U części chorych dochodzi także do umiarkowanego obniżenia stężenia hemoglobiny oraz nieznacznego przyspieszenia opadania krwinek (OB). Ponadto do częstych odchyleń należą podwyższony poziom białka CRP i 2-4-krotnie zwiększona aktywność transaminaz.
Jednakże, diagnostyka HGA opiera się przede wszystkim na określeniu swoistej odpowiedzi immunologicznej oraz wykrywaniu drobnoustroju.
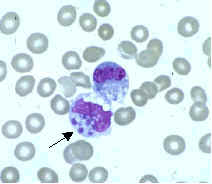
Dowodem na obecność zakażenia A. phagocytophilum jest wykrycie morul w preparacie rozmazu krwi obwodowej lub szpiku barwionym metodą Wrighta lub Giemsy – w ostrej fazie choroby ich obecność stwierdza się u ponad połowy pacjentów.
W diagnostyce serologicznej HGA standardowo stosuje się
1. Metodę immunofluorescencji pośredniej (IFA) w celu określenia miana przeciwciał w surowicy. Stwierdzenie serokonwersji lub przynajmniej 4-krotnego wzrostu poziomu swoistych Ab pozwala na pewne rozpoznanie anaplazmozy (minimalny poziom Ab musi wynosić 64 w ostrej fazie choroby). Możliwe reakcje krzyżowe między A. phagocytophilum i E. chaffeensis, jak również u pacjentów z innymi riketsjozami, gorączką Q, zakażeniem wirusem Epstein-Barr, czy też przy obecności autoprzeciwciał antyleukocytarnych, mogą dawać fałszywie dodatnie wyniki badań serologicznych.
2. Immunoblotting z wykorzystaniem rekombinowanych immunodominujących antygenów A. phagocytophilum (białek błonowych o masie 42-49 kDa). W różnicowaniu zakażeń między A. phagocytophilum a E. chaffeensis określa się obecność w surowicy pacjentów białka p44 (jeden z głównych antygenów, określane jako białko wiążące maltozę MBP).
3. ELISA z możliwością zastosowania rekombinowanego antygenu p44.
Zarówno w rutynowej diagnostyce HGA, jak i badaniach epidemiologicznych, poza testami serologicznymi, swoje zastosowanie znalazły także metody genetyczne:
1. PCR – amplifikacja genu 16S rRNA A. phagocytophilum służy do detekcji i identyfikacji drobnoustroju w próbkach krwi, bioptatach skóry oraz gruczołach ślinowych kleszczy.
2. Elektroforeza w zmiennym polu elektrycznym (PFGE)
3. Typowanie przez sekwencjonowanie wybranych genów (MLST)
Uzyskanie hodowli A. phagocytophilum na ludzkich komórkach promielocytarnych linii HL-60 zakażanych materiałem pobranym od pacjenta, pozwalającej na bezpośrednią obserwację bakterii i szybkiego postępu zmian cytopatycznych w komórkach, stanowi ostateczne i niepodważalne potwierdzenie HGA.
Różnicowanie
Diagnostyka różnicowa anaplazmozy obejmuje:
- gorączkę plamistą Gór Skalistych i inne riketsjozy
- zapalenie mózgu i opon mózgowo-rdzeniowych
- babeszjozę
- zimnicę
Leczenie
Decyzja o rozpoczęciu leczenia chorych na anaplazmozę powinna opierać się na objawach klinicznych i danych epidemiologicznych. Ważne jest jak najwcześniejsze zastosowanie odpowiedniej terapii, ponieważ jej opóźnienie bądź też podanie niewłaściwych leków może prowadzić do ciężkiego przebiegu infekcji i powikłań, a nawet śmierci chorego.
W leczeniu HGA lekami z wyboru są doksycyklina stosowana w dawce 100 mg 2x dziennie przez okres 2 tygodni i tetracykliny podawane 4x dziennie po 500 mg. Ponadto A. phagocytophilum wykazuje znaczną wrażliwość na rifampicynę (przyjmowaną przez 7-10 dni) i fluorochinolony stanowiące alternatywę w przypadku nietolerancji doksycykliny, alergii, leczenia dzieci w wieku < 12 lat i kobiet w ciąży.
Bibliografia
- Andrzej Szczeklik (red.): Choroby wewnętrzne, t. II. Kraków: Medycyna Praktyczna, 2005, s. 2149-2150. ISBN 83-7430-069-8.
- Grygorczuk i inni. Ehrlichioza--choroba mało znana i rzadko rozpoznawana w Polsce. „Wiadomości Lekarskie”. 58 (9–10), s. 456-461, 2005. (pdf)
- Karolina Majchrowska (red.), ''Anaplasma phagocytophilum'' i HGA, 3 stycznia 2010.[1]
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Ehrlichia chaffeensis primarily infects mononuclear leukocytes (predominantly monocytes and macrophages), but may also be seen occasionally in the granulocytes of some patients with severe disease.
(Morulae in cytoplasm of monocyte)
