Arytmogenna kardiomiopatia prawej komory
| ICD-10 |
|---|
Arytmogenna kardiomiopatia prawej komory (arytmogenna dysplazja prawej komory, ang. arrhythmogenic right ventricular cardiomyopathy, ARVC, arrhythmogenic rightventricular dysplasia, ARVD) – rzadki, genetycznie uwarunkowany typ kardiomiopatii o niejasnej etiologii, przebiegający ze zwyrodnieniem tłuszczowym mięśnia sercowego i rozstrzenią prawej komory. Choroba ta wiąże się ze skłonnością do potencjalnie groźnych dla życia arytmii komorowych.
Historia
Chorobę jako pierwszy opisał Giovanni Maria Lancisi w 1736 roku, w książce "De Motu Cordis et Aneurysmatibus", gdzie przedstawił przypadek rodziny z zachorowaniami w czterech pokoleniach[1]. Dopiero w drugiej połowie XX wieku pojawiły się opisy patogenezy choroby; Dalla Volta i wsp. przedstawili swój przypadek w 1961 roku, serie pacjentów opisali Marcus[2], Nava[3] i Thiene[4] w latach 80.
Epidemiologia
Częstość ARVD szacuje się na 1:2 500–5 000[5]. Przypuszcza się, że choroba występuje częściej we Włoszech[3][6][7].
Choroba rzadko występuje rodzinnie.
Etiologia

Podłoże ARVC jest genetyczne. Wykazano związek choroby z mutacjami w loci 1q42-43, 2q31-35, 14q23-24, 14q12-22 i innych. Uważa się, że w patomechanizmie tej kardiomiopatii ważną rolę odgrywa zaburzenie apoptozy.
| Typ | Locus | Gen | Białko | Dziedziczenie | OMIM |
|---|---|---|---|---|---|
| ARVD1 | 14q23-24[8] | TGFB3 | Transformujący czynnik wzrostu β-3 | AD | 107970 |
| ARVD2 | 1q42.1-q43[9] | RYR2 | Sercowy receptor rianodynowy | AD | 600996 |
| ARVD3 | 14q12-q22[8] | 602086 | |||
| ARVD4 | 2q32.1-q32.3 | 602087 | |||
| ARVD5 | 3p21.3, 3p23 | 604400 | |||
| ARVD6 | 10p14-p12 | 604401 | |||
| ARVD7 | 10q22.3 | 609160 | |||
| ARVD8 | 6p24 | DSP | Desmoplakina | AD | 607450 |
| ARVD9 | 12p11 | PKP2 | Plakofilina-2 | 609040 | |
| ARVD10 | 18q12.1-q12.2 | DSG2 | Desmogleina-2 | AD | 610193 |
| ARVD11 | 18q12.1 | DSC2 | Desmokolina-2 | AD | 610476 |
| ARVD12 | 17q21 | JUP | Plakoglobina | AR | 611528 |
Obraz kliniczny i przebieg
W przebiegu arytmogennej dysplazji prawej komory dochodzi do zaniku mięśni prawej komory oraz wynikającego z tego ścieńczenia ścian, powstawania tętniaka i jej powiększenia[10]. Niekiedy dochodzi do zajęcia lewej komory[10]. Choroba ujawnia się w wieku dziecięcym. Dominują objawy niewydolności prawokomorowej i komorowe zaburzenia rytmu. Nierzadko do rozpoznania może doprowadzić dopiero nagła śmierć sercowa – do 20% osób, które doświadczyły jej w ciągu pierwszych 35 lat życia było chore na ARVC[5]. Choroba stanowi częstą przyczynę nagłej śmierci u sportowców[5].
Rozpoznanie
Rozpoznanie oparte jest na obrazie klinicznym i wynikach badań dodatkowych.
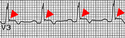
W EKG stwierdza się blok prawej odnogi pęczka Hisa, ujemny załamek T w odprowadzeniach prawokomorowych. W EKG na końcu zespołu QRS w odprowadzeniach znad prawej komory (V1-V3) może pojawić się tzw. fala epsilon. Obserwowane jest także poszerzenie zespołu QRS w tych odprowadzeniach.
Stwierdzenie nacieków tłuszczowych w ścianie prawej komory.
Kryteria rozpoznania
Opracowano kryteria rozpoznania ARVD. Rozpoznanie można postawić, jeśli spełnione są dwa kryteria duże lub jedno duże i dwa małe, lub cztery małe - z różnych grup[11].
- Wywiad rodzinny
- Kryteria duże
- Rodzinna choroba potwierdzona w autopsji lub chirurgicznie
- Kryteria małe
- Dodatni wywiad rodzinny w kierunku przedwczesnych nagłych zgonów (<35. roku życia) z podejrzeniem ARVD jako tła
- Dodatni wywiad rodzinny (rozpoznanie kliniczne oparte na tych kryteriach)
- Kryteria duże
- EKG - nieprawidłowości depolaryzacji lub przewodzenia
- Kryteria duże
- Fale epsilon lub wydłużony (>110 ms) zespół QRS w odprowadzeniach przedsercowych znad prawej komory (V1-V3)
- Kryteria małe
- Późne potencjały w uśrednionym EKG
- Kryteria duże
- EKG - nieprawidłowości repolaryzacji
- Kryteria małe
- Odwrócone załamki T w odprowadzeniach przedsercowych V2 i V3 u pacjentów >12 roku życia i nieobecność bloku prawej odnogi pęczka Hisa
- Kryteria małe
- Arytmie
- Kryteria małe
- Utrwalony lub nieutrwalony częstoskurcz komorowy typu bloku lewej odnogi pęczka Hisa udokumentowany na EKG lub w badaniu Holterowskim lub podczas próby wysiłkowej
- Częste ekstrasystole pochodzenia komorowego (>1000/dobę w badaniu Holterowskim)
- Kryteria małe
- Dysfunkcje globalne lub regionalne i odmienności strukturalne (Rozpoznane w echokardiografii, angiografii, MRI lub scyntygrafii serca)
- Kryteria duże
- Znaczne poszerzenie i redukcja frakcji wyrzutowej prawej komory i brak lub niewielkie upośledzenie czynności skurczowej lewej komory
- Tętniaki prawej komory (obszary akinezy lub dyskinezy z diastolicznymi wybrzuszeniami). Znaczne odcinkowe poszerzenie prawej komory
- Kryteria małe
- Łagodna rozstrzeń prawej komory lub łagodne zmniejszenie frakcji wyrzutowej i prawidłowa lewa komora
- Łagodne odcinkowe poszerzenie prawej komory
- Miejscowa hipokineza prawej komory
- Kryteria duże
- Tkanka ściany komory
- Kryteria duże
- Zastąpienie miocardium tkanką włóknisto-tłuszczową stwierdzone w biopsji endomiokardialnej.
- Kryteria duże
Rozpoznanie różnicowe
- anomalia Uhla
- anomalia Ebsteina
- ubytek przegrody międzyprzedsionkowej
- zawał prawej komory
- niedomykalność zastawek prawego serca.
Leczenie
Leczenie jest objawowe i polega na oszczędzającym trybie życia oraz leczeniu zaburzeń rytmu. Przeciwwskazane jest uprawianie sportu i unikanie każdego większego wysiłku fizycznego. Zaburzenia rytmu leczone są farmakologicznie, amiodaronem lub sotalolem, w przypadku nieskuteczności takiego leczenia lub nietolerancji leków do rozważenia pozostaje radioablacja miejsc arytmogennych. ARVC jest wskazaniem do wszczepienia kardiowertera-defibrylatora (ICD). W schyłkowym okresie choroby należy rozważyć transplantację serca.
Rokowanie
Rokowanie na ogół jest poważne, wszczepienie ICD poprawia je.
Zobacz też
- choroba Naxos
- zespół Carvajala
Przypisy
- ↑ Lancisi GM. De Motu Cordis et Aneurysmatibus. Neapol. 1736.
- ↑ Marcus FI, Fontaine GH, Guiraudon G, Frank R, Laurenceau JL, Malergue C, Grosgogeat Y. Right ventricular dysplasia: a report of 24 adult cases. „Circulation”. 65. 2, s. 384-98, 1982. PMID: 7053899.
- ↑ a b Nava A, Thiene G, Canciani B, Scognamiglio R, Daliento L, Buja G, Martini B, Stritoni P, Fasoli G. Familial occurrence of right ventricular dysplasia: a study involving nine families. „J Am Coll Cardiol”. 12. 5, s. 1222-8, 1988. PMID: 3170963.
- ↑ Thiene G, Nava A, Corrado D, Rossi L, Pennelli N. Right ventricular cardiomyopathy and sudden death in young people. „N Engl J Med”. 318. 3, s. 129-33, 1988. PMID: 3336399.
- ↑ a b c Anneline SJM te Riele, Harikrishna Tandri, David A Bluemke, Arrhythmogenic right ventricular cardiomyopathy (ARVC): cardiovascular magnetic resonance update, „Journal of Cardiovascular Magnetic Resonance”, 16 (1), 2014, s. 50, DOI: 10.1186/s12968-014-0050-8, ISSN 1097-6647, PMID: 25191878, PMCID: PMC4222825 [dostęp 2018-06-29].
- ↑ Norman MW., McKenna WJ. Arrhythmogenic right ventricular cardiomyopathy: perspectives on disease.. „Z Kardiol”. 88. 8, s. 550-4, 1999. PMID: 10506390.
- ↑ Thiene G, Corrado D, Basso C. Arrhythmogenic right ventricular cardiomyopathy/dysplasia. „Orphanet J Rare Dis”. 2, s. 45, 2008. DOI: 10.1186/1750-1172-2-45. PMID: 18001465.
- ↑ a b Severini GM, Krajinovic M, Pinamonti B, Sinagra G, Fioretti P, Brunazzi MC, Falaschi A, Camerini F, Giacca M, Mestroni L. A new locus for arrhythmogenic right ventricular dysplasia on the long arm of chromosome 14. „Genomics”. 31. 2, s. 193-200, 1997. PMID: 8824801.
- ↑ Rampazzo A, Nava A, Erne P, Eberhard M, Vian E, Slomp P, Tiso N, Thiene G, Danieli GA. A new locus for arrhythmogenic right ventricular cardiomyopathy (ARVD2) maps to chromosome 1q42-q43. „Hum Mol Genet”. 4. 11, s. 2151-4, 1996. PMID: 8589694.
- ↑ a b Hugh Calkins, Arrhythmogenic right ventricular dysplasia, „Current Problems in Cardiology”, 38 (3), 2013, s. 103–123, DOI: 10.1016/j.cpcardiol.2012.12.002, ISSN 1535-6280, PMID: 23453020 [dostęp 2018-06-29].
- ↑ McKenna WJ, Thiene G, Nava A, Fontaliran F, Blomstrom-Lundqvist C, Fontaine G, Camerini F. Diagnosis of arrhythmogenic right ventricular dysplasia/cardiomyopathy. Task Force of the Working Group Myocardial and Pericardial Disease of the European Society of Cardiology and of the Scientific Council on Cardiomyopathies of the International Society and Federation of Cardiology.. „Br Heart J”. 71. 3, s. 215-8, 1994. PMID: 8142187.
Linki zewnętrzne
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Oryginalnym przesyłającym był Ksheka z angielskiej Wikipedii, Licencja: CC-BY-SA-3.0
The epsion wave, seen in arrhythmogenic right ventricular dysplasia.
Autor: Thiene et al, Licencja: CC BY 2.0
MRI in a patient affected by ARVC/D (long axis view of the right ventricle): note the transmural diffuse bright signal in the RV free wall on spin echo T1 (a) due to massive myocardial atrophy with fatty replacement (b).
Autor: Thiene et al., Licencja: CC BY 2.0
Transmission electron microscopy of the intercellular junction between two adjacent myocytes in ARVC/D. Note the presence of abnormal desmosomes, either long (arrows) or short-repeated structures (insert)
Autor: Thiene G, Corrado D, Basso C., Licencja: CC BY 2.0
A 17 year old asymptomatic male athlete who died suddenly during a soccer game. Note the biventricular involvement at long axis in vitro MRI (a), with transmural fibro-fatty replacement in the RV free wall (b) and focal subepicardial in the LV free wall (c).
Autor: Thiene et al., Licencja: CC BY 2.0
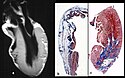
Typical histologic features of ARVC/D. Ongoing myocyte death (a) with early fibrosis and adipocytes infiltration (b).
Autor: Oryginalnym przesyłającym był Ksheka z angielskiej Wikipedii, Licencja: CC-BY-SA-3.0
Monomorphic ventricular tachycardia originating from the right ventricular outflow tract. This particular patient had no response to en:adenosine 18mg fast IV push, and broke soon after an amiodarone IV push was given. The patient was eventually diagnosed with en:arrhythmogenic right ventricular dysplasia (ARVD). His baseline EKG had epsilon waves, which are characteristic of ARVD. The patient also had family history of sudden death of males in their early 20s (brother and an uncle) and echocardiographic findings consistent with ARVD.