Auksyny
Auksyny (ze stgr. αὔξω auksō lub αὐξάνω auksanō "powiększać") – grupa substancji chemicznych zaliczanych do hormonów roślinnych. Stymulują wzrost roślin oraz wpływają na kształtowanie się owoców partenokarpicznych i odgrywają istotną rolę w procesach adaptacji takich jak fototropizm i geotropizm. Auksyny wykazują cechy zarówno hormonów w znaczeniu zbliżonym do pojęcia używanego na określenie substancji regulacyjnych ssaków oraz cechy morfogenów, czyli substancji regulujących proces morfogenezy roślin[1]. Pierwszą odkrytą auksyną jest kwas indolilooctowy (IAA)[2]. Jest on syntezowany w merystemie wierzchołkowym pędu, młodych liściach, zarodku oraz w małych ilościach w korzeniu. Transport IAA przez parenchymę ma unikatowy charakter. Jest on wolny (5–20 mm/h) i kierunkowy (polarny), jednak nie jest zależny od grawitacji. Ponadto IAA przemieszcza się szybko i bezkierunkowo poprzez floem (5–20 cm/h).
Najważniejsze auksyny naturalne:
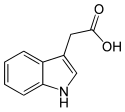
- kwas indolilo-3-octowy (IAA)[2],
- kwas indolilo-3-masłowy (IBA)[3],
- kwas fenylooctowy (PAA)[2],
- indoliloacetonitryl (IAN),
- kwas indolilo-3-propionowy (IPA);
syntetyczne regulatory wzrostu o właściwościach zbliżonych do auksyn:
- kwas naftylo-1-octowy (NAA)[3],
- kwas 2,4-dichlorofenoksyoctowy (2,4-D)[2],
- kwas 2,4,5-trichlorofenoksyoctowy (2,4,5-T),
- kwas 2-metoksy-3,6-dichlorobenzoesowy (dicamba),
- kwas 4-amino-3,5,6-trichloropikolinowy (picloran, tordon).
Auksyny mogą w organizmie roślinnym występować w postaci wolnej albo w połączeniu z cukrami, aminokwasami lub peptydami. Pochodne fitohormonów nazywane są koniugatami i zwykle nie wykazują aktywności biologicznej. Połączenie związków odbywa się przy udziale grupy karboksylowej IAA. U roślin dwuliściennych wykryto amidy IAA, zaś u jednoliściennych koniugatami są zwykle estry IAA. Tworzenie koniugatów umożliwia odwracalną inaktywację, powstałe związki są formą transportową hormonów. Odtworzenie aktywnej postaci fitohormonu jest możliwe dzięki obecności enzymów hydrolizujących. Wykazano, że w tkankach roślin obecne są enzymy hydrolizujące estry i amidy IAA[2].
Biosynteza
Główny przedstawiciel auksyn, IAA, może być wytwarzany w organizmie roślinnym na dwa sposoby. Szlak pierwszy rozpoczyna się od tryptofanu (Trp-zależny), szlak drugi jest niezależny od tego związku i określany jako Trp-niezależny[4][5]. Biosynteza w efekcie szlaku Trp-zależnego jest niezbędna do embriogenezy, wzrostu siewek, rozwoju kwiatu, powstawania naczyń i innych procesów rozwojowych. Rola szlaku Trp-niezależnego jest słabo wyjaśniona. Synteza IAA z tryptofanu przebiega w dwóch etapach. Etap pierwszy prowadzi do powstania kwasu indolo-3-pirogronowego i jest katalizowany przez enzym TAA należący do rodziny aminotransferaz. Etap drugi katalizowany jest przez enzym YUCCA (YUC) z rodziny monooksygenaz flawinowych. U Arabidopsis thaliana istnieje 11 genów YUC. Możliwy jest udział kilku innych enzymów w syntezie IAA. CYP79B2/CYP79B3, nitrylazy, oksydaza aldehydowa dekarboksylaza IPA mogą uczestniczyć w syntezie w niewielkim stopniu lub tylko u niektórych gatunków[6][7].
Działanie

Działanie auksyn związane jest z dwoma rodzajami reakcji. Odpowiedzi szybkie nie wiążą się z regulacją ekspresji genów i prawdopodobnie są związane z białkami wiążącymi auksyny (ang. auxin-binding proteins – ABP). Druga grupa reakcji to odpowiedzi powolne związane z ekspresją genów i białkami z domeną F (ang. F-box proteins)[3].
Jedną z ważniejszych funkcji auksyn jest pobudzenie wzrostu komórek roślin. Mają one pośredni wpływ na rozciągliwość ścian komórkowych. Mechanizm regulacji powiększania komórki nie jest w pełni wyjaśniony. Opisywana w literaturze koncepcja wzrostu kwasowego przyjmuje, że auksyny pobudzają działanie pompy protonowej w błonach komórkowych, w wyniku czego jony hydroniowe (H3O+) przenikają z cytoplazmy do ściany komórkowej. Powoduje to zakwaszenie ściany komórkowej rozerwanie niekowalencyjnych wiązań między składnikami ściany oraz i aktywację białek z grupy ekspansyn, będących enzymami hydrolitycznymi hemicelulozy. Ściana wówczas staje się plastyczna i zdolna do rozciągania pod wpływem ciśnienia turgorowego i powiększania się komórki. Hipoteza wzrostu kwasowego znajduje potwierdzenie w doświadczeniach z zakwaszeniem apoplastu, które także prowadzi do wzrostu komórki bez obecności IAA. Zatrzymanie wzrostu komórki następuje po umieszczeniu jej w buforze. W takich warunkach wzrost nie jest indukowany przez IAA. Dowodem potwierdzającym hipotezę jest również możliwość zahamowania reakcji na IAA przez pozbawienie środowiska jonów K+. Przyjmuje się, że pompa protonowa działa na zasadzie antyportu z tymi jonami. Brak jest jednak bezpośrednich dowodów w postaci wyizolowanego białka będącego receptorem i pompą protonową. Nie zawsze stwierdza się również konieczność obniżenia pH apoplastu przy wzroście komórki. Możliwe, że istnieje więcej niż jeden mechanizm stymulacji wzrostu komórki przez auksyny. Nie jest też jasne czy inne niż IAA auksyny indukują wzrost na podobnej zasadzie[2].
Poza wzrostem komórek auksyny stymulują także podziały komórkowe, indukują tworzenie się korzeni przybyszowych, wpływają na powstawanie owoców oraz kształtowanie się ksylemu. U truskawki powstanie owocu rzekomego związane jest w wytwarzaniem auksyn przez orzeszki. Możliwa jest stymulacja rozwoju dna kwiatowego przez podanie auksyny zastępującej substancję wytwarzaną przez orzeszki. Auksyny wpływają hamująco na formowanie się tkanki odcinającej i opadanie liści, są także odpowiedzialne za zjawisko dominacji wierzchołkowej, polegające na zahamowaniu rozwoju pąków pędowych. Auksyny wytwarzane przez merystem wierzchołkowy powodują że pąki znajdujące się poniżej pozostają w stanie uśpienia. Gdy wierzchołek pędy głównego zostanie usunięty lub uszkodzony rośliny rozkrzewiają się w wyniku wzrostu obudzonych pąków pachwinowych. Podwyższone stężenie auksyn powoduje zahamowanie wzrostu wydłużeniowego korzeni. Wysoka zawartość auksyn prowadzi również do zwiększonej ilości kwiatów żeńskich, a jeśli kwiaty są obupłciowe następuje symulacja rozwoju zalążni i hamowanie rozwoju pręcików. U roślin dwupiennych, takich jak konopie siewne, obserwowano powstawanie kwiatów żeńskich na osobnikach męskich[8].
Transport
Przemieszczanie auksyn w roślinie odbywa się na dwa sposoby. Z organów będących źródłem auksyn takich jak kwiaty albo młode liście auksyny w sposób nieregulowany przemieszczane są przez dojrzały floem. Transport floemem jest stosunkowo szybki. Wolniej i w sposób polegający regulacji auksyn przemieszczane są przez kambium. Transport z komórki do komórki odbywa się od pędu w kierunku korzenia. Powolne, kontrolowane przemieszczanie auksyn w ograniczonym zakresie odbywa się także przy udziale innych tkanek[9]. Polarny transport auksyn został wykazany dla IAA i IBA. Szybkość przemieszczania tych fitohormonów została określona na 8 do 10 mm na godzinę[10].
Receptory
Odbiór informacji przenoszonej przez hormon jest możliwy dzięki obecności w kompetentnych komórkach specyficznych białek pełniących rolę receptora sygnału. Receptory auksyn określane jako białka wiążące auksyny (ABP) zostały wykryte w błonie komórkowej oraz siateczce śródplazmatycznej i tonoplaście. Białko pełniące funkcję receptora jest homodimerem o masie około 40-45 kDa. Masa podjednostek to około 20-22 kDa. Funkcja ABP została potwierdzona w doświadczeniach na sysntetycznej błonie fosfolipidowej, która ulegała polaryzacji po dodaniu do układu auksyny, ABP i ATP. Wzrost indukowany przez auksyny może zostać zahamowany przez podanie przeciwciał specyficznych wobec ABP. Doświadczenia wykazały również zwiększoną zawartość ABP w tkankach silnie reagujących na auksyny w stosunku do tkanek w niewielkim stopniu reagującym na IAA[2].
Zastosowanie w rolnictwie
Niezapłodnione kwiaty niektórych gatunków potraktowane auksyną IAA powiększają swoją zalążnię i przekształcają się w owoce partenokarpiczne, niemające nasion, co jest wykorzystywane w rolnictwie do produkcji bezpestkowych owoców i warzyw[8]. Często stosowana w szklarniach.
W niewielkich stężeniach mogą być stosowane w ukorzeniaczach.
Kwas 2,4-dichlorofenoksyoctowy (tzw. 2,4-D), będący syntetyczną auksyną, hamuje wzrost i rozwój roślin. Rośliny jednoliścienne są mniej wrażliwe na 2,4-D niż dwuliścienne, co sprawia, że 2,4-D jest stosowany do opryskiwania upraw roślin jednoliściennych takich jak żyto, pszenica, w celu wyniszczenia chwastów dwuliściennych[8].
Zbyt duże stężenie auksyn pobudza produkcję etylenu, co opóźnia wzrost rośliny.
Historia odkrycia
Istnienie substancji wpływających na wzrost koleoptyla wykazali niezależnie w roku 1927 uczony ukraiński N.G. Chołodny i w roku 1928 F. Went. Odcięte wierzchołki koleoptyla umieszczano na bloczkach agarowych. Jeśli po kilku godzinach bloczek agarowy przykładano po jednej stronie pozbawionego wierzchołka koleoptyla następowało wygięcie w wyniku szybszego wzrostu tej strony. Substancją dyfundująca do bloczka agarowego okazał się kwas indolilo-3-octowy[8].
Auksyny u mikroorganizmów

Zdolność wytwarzania IAA jest szeroko rozpowszechniona u bakterii zasiedlających ryzosferę. Wytwarzana auksyna może być stosowana zarówno w patogenezie, jak i w stymulacji wzrostu roślin[11][12]. Genetyczny mechanizm syntezy auksyn został dobrze poznany u Pseudomonas, Agrobacterium, Rhizobium, Bradyrhizobium i Azospirillum. Stymulacja wzrostu korzeni roślin umożliwia wejście mikroorganizmom w relację symbiotyczną i obejście mechanizmów obronnych roślin. Bakterie glebowe poza IAA wytwarzają także kwas 3-indolilopirogronowy i prawdopodobnie indolilo-3-acetoamid. Geny niezbędne do biosyntezy auksyn mogą być zlokalizowane zarówno na plazmidzie, jak i na chromosomie[13].
Przypisy
- ↑ J. Friml. Auxin transport - shaping the plant. „Curr Opin Plant Biol”. 6 (1), s. 7–12, Feb 2003. PMID: 12495745.
- ↑ a b c d e f g Lewak Stanisław: Regulacja procesów fizjologicznych przez czynniki endogenne. W: Fizjologia roślin. red. Kopcewicz Jan, Lewak Stanisław. Warszawa: Wydawnictwo Naukowe PWN, 2002, s. 137–166. ISBN 83-01-13753-3.
- ↑ a b c S. Simon, J. Petrášek. Why plants need more than one type of auxin. „Plant Sci”. 180 (3), s. 454–460, Mar 2011. DOI: 10.1016/j.plantsci.2010.12.007. PMID: 21421392.
- ↑ A.W. Woodward, B. Bartel. Auxin: regulation, action, and interaction. „Ann Bot”. 95 (5), s. 707–735, Apr 2005. DOI: 10.1093/aob/mci083. PMID: 15749753.
- ↑ Y. Mano, K. Nemoto. The pathway of auxin biosynthesis in plants. „J Exp Bot”. 63 (8), s. 2853–2872, May 2012. DOI: 10.1093/jxb/ers091. PMID: 22447967.
- ↑ Y. Zhao. Auxin biosynthesis and its role in plant development. „Annu Rev Plant Biol”. 61, s. 49–64, 2010. DOI: 10.1146/annurev-arplant-042809-112308. PMID: 20192736.
- ↑ K. Mashiguchi, K. Tanaka, T. Sakai, S. Sugawara i inni. The main auxin biosynthesis pathway in Arabidopsis. „Proc Natl Acad Sci U S A”. 108 (45), s. 18512–18517, Nov 2011. DOI: 10.1073/pnas.1108434108. PMID: 22025724.
- ↑ a b c d Alicja Szweykowska: Fizjologia roślin. Poznań: Wydawnictwo Naukowe Uniwersytetu im. Adama Mickiewicza, 2002, s. 169–198. ISBN 83-232-0815-8.
- ↑ J. Petrásek, J. Friml. Auxin transport routes in plant development. „Development”. 136 (16), s. 2675–2688, Aug 2009. DOI: 10.1242/dev.030353. PMID: 19633168.
- ↑ A.M. Rashotte, J. Poupart, C.S. Waddell, G.K. Muday i inni. Transport of the two natural auxins, indole-3-butyric acid and indole-3-acetic acid, in Arabidopsis. „Plant Physiol”. 133 (2), s. 761–772, Oct 2003. DOI: 10.1104/pp.103.022582. PMID: 14526119.
- ↑ C.L. Patten, B.R. Glick. Bacterial biosynthesis of indole-3-acetic acid. „Can J Microbiol”. 42 (3), s. 207–220, Mar 1996. PMID: 8868227.
- ↑ A. Costacurta, J. Vanderleyden. Synthesis of phytohormones by plant-associated bacteria. „Crit Rev Microbiol”. 21 (1), s. 1–18, 1995. DOI: 10.3109/10408419509113531. PMID: 7576148.
- ↑ S. Spaepen, J. Vanderleyden, R. Remans. Indole-3-acetic acid in microbial and microorganism-plant signaling. „FEMS Microbiol Rev”. 31 (4), s. 425–448, Jul 2007. DOI: 10.1111/j.1574-6976.2007.00072.x. PMID: 17509086.
Bibliografia
- Jankiewicz L.S. (red.), Regulatory wzrostu i rozwoju roślin, Tom 1. Właściwości i działanie, PWN, Warszawa 1997.
Media użyte na tej stronie
Autor: Clemson University - USDA Cooperative Extension Slide Series, , Bugwood.org, Licencja: CC BY-SA 3.0 us
Agrobacterium tumefaciens gall at the root of Carya illinoensis
kwas fenylooctowy
Autor: William M. Gray, Licencja: CC BY 2.5
Wild type Arabidopsis thaliana (left), auxin signal-transduction mutant (axr2, right)
البنية الجزيئية لحمض إندول 3-الأسيتيك