Autodysocjacja wody

Autodysocjacja wody lub autoprotoliza wody – samorzutna autodysocjacja cząsteczek wody pozostających w stanie ciekłym. Proces ten ma duże znaczenie praktyczne – decyduje m.in. o zdolności wody do rozpuszczania substancji jonowych a stała równowagi tej reakcji stanowi podstawę skali pH.
Przebieg reakcji autodysocjacji wody:
- H2O + H2O ⇌ H3O+ + OH−
Stałe reakcji
Zaniedbując aktywności, stałą równowagi tej reakcji można zdefiniować wzorem:
W warunkach standardowych ma ona wartość 3,23×10−18 co w praktyce oznacza, że jest ona bardzo silnie przesunięta w stronę substratu, czyli niezdysocjowanej formy wody. W idealnie czystej wodzie w warunkach standardowych stężenie jonów [H3O]+ i [OH]− wynosi ok. 10−7 mol/l[1].
Stała kwasowa dana wzorem:
- Ka = Keq[H2O] = ([H3O+][OH−])/[H2O]
- gdzie [H2O] ≈ 55,6 mol/dm3
ma w warunkach standardowych wartość 1,8×10−16[2].
Podane powyżej wartości otrzymane są przy użyciu stężenia molowego wody. Wartości numeryczne tych stałych byłyby znacząco inne w przypadku użycia aktywności rozpuszczalnika zamiast jego stężenia, ponieważ aktywność czystego rozpuszczalnika jest w termodynamice chemicznej zwykle przyjmowana jako równa jedności, podczas gdy stężenie molowe czystej wody wynosi około 55,6 mol/l.
Iloczyn jonowy wody
W przypadku rozcieńczonych roztworów wodnych można przyjąć, że stężenie molowe niezdysocjowanej formy wody jest stałą, a aktywność czystego rozpuszczalnika wynosi 1. Obserwacja ta stanowi podstawę definicji iloczynu jonowego wody. Zaniedbując aktywności:
- Kw = Ka[H2O] = K(dys, w)[H2O]2 = [H3O+][OH−]
Wartość iloczynu jonowego wody w temperaturze pokojowej wynosi ok. 10−14.
Podobnie jak dla innych bardzo małych wartości wywodzących się z definicji stałej równowagi, jak iloczyn rozpuszczalności czy stała dysocjacji lub przy określaniu stężenia jonów hydroniowych oraz wodorotlenowych, wartość iloczynu jonowego podaje się jako −log10Kw (p jest operatorem oznaczającym obliczenie −log10):
- pKw = −log10Kw
Wartość pKw ≈ 14 (w temperaturze pokojowej).
W innych temperaturach/ciśnieniach
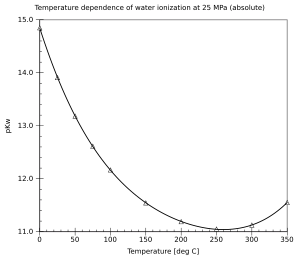
Przy normalnym ciśnieniu atmosferycznym woda jest ciekła w zakresie 0–100 °C. Wraz ze wzrostem temperatury dysocjacja staje się łatwiejsza (reakcja endotermiczna) i iloczyn jonowy Kw rośnie, a pKw spada. Wartość pKw zmienia się od ok. 14,95 w temperaturze 0 °C przez 14,0 (25 °C) i 13,0 (60 °C) do 11,25 w temperaturze 100 °C. W mniejszym stopniu, iloczyn jonowy wody zależy również od ciśnienia (zwiększona dysocjacja przy wyższym ciśnieniu). W warunkach podwyższonego ciśnienia, woda może pozostać ciekła aż do temperatury krytycznej. Iloczyn jonowy ciekłej wody zwiększa się ze zwiększającą się temperaturą aż do temperatury około 260 °C, a potem spada. Właściwości kwasowo-zasadowe wody w szerokim zakresie temperatur i ciśnień mają duże znaczenie praktyczne (na przykład, korozja w elektrowniach).
Związek z pH
Wartość pKw ma kluczowe znaczenie dla definicji skali pH. Między pH i pKw występuje zależność:
- pH + pOH = pKw
W idealnie czystej wodzie stężenia jonów [OH]− i [H3O]+ są sobie równe, stąd:
oraz (po zlogarytmowaniu obu stron):
- pH = pOH = ½pKw
Wartość pH = pOH w czystej wodzie, tzw. pH neutralne, wynosi 7,00 (25 °C, ciśnienie absolutne 100 kPa) i określa umowny środek skali pH25 °C. Generalnie, wartość neutralnego pH zależy od temperatury (i w mniejszym stopniu od ciśnienia) i jest równe ½pKw.
Zobacz też
Przypisy
- ↑ 2. Równowagi chemiczne. W: Douglas A. Skoog, Donald M. West, James F. Holler i Stanley R. Crouch: Podstawy Chemii Analitycznej. T. 1. Warszawa: Wydawnictwo Naukowe PWN, 2006, s. 232. ISBN 978-83-01-14885-0.
- ↑ John McMurry: Chemia organiczna. Wyd. 3. T. 1. Warszawa: PWN, 2005, s. 45–46. ISBN 83-01-14406-8.
Media użyte na tej stronie
Autor: Stan J Klimas z angielskiej Wikipedii, Licencja: Attribution
Dependence of water ionization constant on pressure at 25 °C. Based on data from "Release on the Ionization Constant of H2O". International Association for Properties of Water and Steam. August 2007. Image author: Stan J. Klimas. Created using Gnumeric on Linux.
(c) Stan J Klimas z angielskiej Wikipedii, CC BY 3.0
Temperature dependence of the water ionization constant. Based on data from "Release on the Ionization Constant of H2O". International Association for Properties of Water and Steam. August 2007. Image author: Stan J. Klimas. Created using Gnumeric on Linux.
Autoprotolysis of water, giving hydroxide and hydronium ions.