Azotany
| Ten artykuł od 2011-12 zawiera treści, przy których brakuje odnośników do źródeł. |
| |||||||||||||||
| |||||||||||||||
 rozkład potencjału elektrycznego jonu azotanowego | |||||||||||||||
| |||||||||||||||
| Ogólne informacje | |||||||||||||||
| Wzór sumaryczny | NO− 3 | ||||||||||||||
| Masa molowa | 62,00 g/mol | ||||||||||||||
| Identyfikacja | |||||||||||||||
| PubChem | 943 | ||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| Podobne związki | |||||||||||||||
| Podobne związki | azotyny | ||||||||||||||
Azotany (nazwa systematyczna: trioksydoazotany(1−); w systemie Stocka: azotany(V)) – grupa związków chemicznych, sole i estry kwasu azotowego (HNO
3).
Azotany – sole kwasu azotowego
Azotany są krystalicznymi substancjami, dobrze rozpuszczalnymi w wodzie. Mają silne właściwości utleniające[1][potrzebny numer strony].
Azotany otrzymuje się w reakcji: kwas azotowy + metal lub tlenek/wodorotlenek/węglan metalu.
Azotany należą do V grupy analitycznej anionów, wykrywa się je za pomocą m.in. próby obrączkowej.
Mogą występować w przyrodzie jako minerały saletry, np. saletra chilijska (nitronatryt), saletra indyjska (nitrokalit).
Znajdują zastosowanie jako nawozy mineralne, materiały wybuchowe, do produkcji barwników, w lecznictwie oraz jako topniki.
Do wykrywania azotanów, po ich wstępnej redukcji do azotynów, można wykorzystać odczynnik Griessa[2].
Struktura
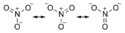
Wszystkie azotany zawierają jon azotanowy NO−
3. Jon ten wykazuje strukturę płaską. Atom azotu jest w stanie hybrydyzacji sp². Zhybrydyzowane orbitale tworzą wiązania σ z trzema atomami tlenu. Ponadto pokrywanie się niezhybrydyzowanego, prostopadłego do płaszczyzny cząsteczki orbitalu p z odpowiednimi orbitalami p atomów tlenu powoduje utworzenie zdelokalizowanych orbitali π. Poza tym, wokół każdego atomu tlenu zlokalizowane są po dwie niewiążące pary elektronowe. Zgodnie z powyższym, wszystkie wiązania N−O są równocenne. Ich długość wynosi 124 pm, a kąt pomiędzy nimi 120°.
W przypadku przyjęcia przez jon azotanowy kationu, np. metalu czy wodoru i utworzenia soli lub kwasu azotowego, jedna z niewiążących par elektronowych jednego z atomów tlenu jest zużywana na utworzenie z nim wiązania σ. W efekcie następuje wydłużenie wiązania tego atomu tlenu z atomem azotu, a także powiększenie się kąta pomiędzy wiązaniami atomu azotu z pozostałymi atomami tlenu i nieznacznym ich skróceniem.
Przykładowe azotany nieorganiczne
- azotan amonu (saletra amonowa)
- azotan potasu (saletra indyjska)
- azotan sodu (saletra chilijska)
- azotan wapnia (saletra norweska)
- azotan baru
- azotan srebra(I)
Azotany organiczne
Organiczne sole kwasu azotowego
Zasadowe związki organiczne, np. aminy, tworzą z kwasem azotowym sole amoniowe, np.
- azotan metyloamoniowy, [CH
3NH
3]+
[NO
3]−
– dodatek do materiałów wybuchowych[3] - azotan etyloamoniowy, [C
2H
5NH
3]+
[NO
3]−
– pierwsza ciecz jonowa występująca w stanie ciekłym w temperaturze pokojowej[4]
Estry kwasu azotowego
Estry kwasu azotowego mają wzór ogólny R−O−NO
2, gdzie R jest dowolną resztą organiczną.
Wobec estrów kwasu azotowego zamiast nazwy „azotan związku” (np. azotan celulozy) używa się często niezbyt poprawnej nazwy „nitrozwiązek” (np. nitroceluloza) przysługujących związkom zawierającym grupę nitrową (−NO
2) połączoną bezpośrednio z atomem węgla. Wynika to ze względów historycznych i głębokiego zakorzenienia tych nazw.
Przykładowe estry kwasu azotowego:
- nitrogliceryna
- nitroglikol
- nitroceluloza
- nitromannit
Azotany w akwarium
Azotany są końcowym produktem przemiany azotowej tzw. cyklu azotowego realizowanym przez bakterie nitryfikacyjne, odpadowych białek, mocznika oraz amoniaku. W akwarium pochłaniają je rośliny oraz w mniejszym stopniu glony, a usuwane są poprzez przekształcenie do wolnego azotu przez beztlenowe bakterie denitryfikacyjne w specjalnym filtrze (denitryfikatorze), przez tzw. strefy beztlenowe w podłożu lub podmianę wody. Azotany są uważane za najmniej szkodliwe ze wszystkich związków azotowych. Dopuszczalne krótkotrwałe stężenie dla ryb w akwariach słodkowodnych wynosi do 50 mg/l. Organizmy morskie mają znacznie mniejszą tolerancję, np. koralowce wymagają zawartości poniżej 5 mg/l.
Stężenia w akwariach słodkowodnych
- poniżej 5 mg/l – nieszkodliwe
- od 5 czasem 10 mg/l – poziom utrzymywany w akwariach ze specjalnym filtrem (denitryfikatorem)
- do 40 mg/l – wspomagają rozwój roślin
- 40–80 mg/l – powodują wzrost glonów
- 80–140 mg/l – zahamowanie wzrostu roślin i gwałtowny wzrost glonów
- ponad 140 mg/l – niebezpieczne dla ryb i roślin.
Normy spożycia
Akceptowalne dzienne spożycie (ADI) azotanów w Polsce i Unii Europejskiej wynosi 3,65 mg/kg masy ciała[5]a ich dopuszczalna zawartość w wodociągowej wodzie pitnej to 50 mg/l[6].
Wpływ na zdrowie
Azotany są częścią diety każdego człowieka[5], ponadto są syntetyzowane w organizmie z argininy[7]. Najczęściej znajdują się w warzywach[6], dlatego dieta wegetariańska prowadzi do ich wyższego spożycia[7] (największe właściwości kumulujące mają warzywa korzeniowe i nowalijki, przede wszystkim szpinak, rzodkiewka, sałata, seler, marchewka, wczesna kapusta, buraki) oraz w wodzie studziennej.
W połowie XX w. pojawiły się obawy co do szkodliwości azotanów w pożywieniu. Wzrosły one w latach 70. po zaobserwowaniu, że mogą one reagować z aminami drugorzędowymi z wytworzeniem rakotwórczych N-nitrozoamin[7]. W raporcie opublikowanym w 2003 r. przez Joint FAO/WHO Expert Committee on Food Additives stwierdzono jednak, że w ujęciu ogólnym badania epidemiologiczne nie wykazały jednoznacznie zwiększonego ryzyka raka wraz ze wzrostem spożycia azotanów oraz że brak jest dowodów na rakotwórczość azotanów dla ludzi[8]. Potwierdzają to późniejsze badania epidemiologiczne, choć czasem stwierdza się takie powiązanie, zazwyczaj o niedużych efektach[9]. Istnieją jednak grupy ludzi, dla których spożywanie azotanów jest wyraźnie niekorzystne, np. chorzy na przełyk Barretta[7].
Spożywanie azotanów ma też szereg korzystnych efektów zdrowotnych, takich jak obniżenie ciśnienia krwi, poprawa funkcjonowania śródbłonka, inhibicja agregacji płytek krwi, ochrona przez zespołem poreperfuzyjnym, poprawa wydolności fizycznej, ochrona przed mikrobami (np. powodującymi próchnicę zębów, infekcje przewodu pokarmowego lub infekcje skóry)[7][9]. Postuluje się, że zwiększenie norm spożycia azotanów przyniosłoby więcej korzyści zdrowotnych niż efektów niekorzystnych[10].
Zobacz też
Przypisy
- ↑ Encyklopedia techniki. Chemia, Władysław Gajewski (red.), Warszawa: Wydawnictwa Naukowo-Techniczne, 1965, OCLC 33835352.
- ↑ Donald L. Granger i inni, Measurement of nitrate and nitrite in biological samples using nitrate reductase and Griess reaction, „Methods in Enzymology”, 268, 1996, s. 142–151, DOI: 10.1016/S0076-6879(96)68016-1, PMID: 8782580 (ang.).
- ↑ Burlington Northern tank-car explodes in South Wenatchee killing two people and injuring 66 on August 6, 1974, HistoryLink.org – the Free Online Encyclopedia of Washington State History [dostęp 2021-04-06].
- ↑ K.N. Marsh, J.A. Boxall, R. Lichtenthaler, Room temperature ionic liquids and their mixtures–a review, „Fluid Phase Equilibria”, 219, 2004, s. 93–98, DOI: 10.1016/j.fluid.2004.02.003 (ang.).
- ↑ a b Rozporządzenie Komisji (WE) nr 1881/2006 z dnia 19 grudnia 2006 r. ustalające najwyższe dopuszczalne poziomy niektórych zanieczyszczeń w środkach spożywczych, Eur-lex, 19 grudnia 2006 [dostęp 2021-04-06].
- ↑ a b Dyrektywa Parlamentu Europejskiego i Rady (UE) 2020/2184 z dnia 16 grudnia 2020 r. w sprawie jakości wody przeznaczonej do spożycia przez ludzi (wersja przekształcona), EUR-Lex, 16 grudnia 2020 [dostęp 2021-04-06].
- ↑ a b c d e Mark Gilchrist, Paul G. Winyard, Nigel Benjamin, Dietary nitrate – Good or bad?, „Nitric Oxide”, 22 (2), 2010, s. 104–109, DOI: 10.1016/j.niox.2009.10.005 [dostęp 2021-04-06] (ang.).
- ↑ Comments, [w:] G.J.A. Speijers, P.A. van den Brandt, Nitrate (and potential endogenous formation of N-nitroso compounds), Internationally Peer Reviewed Chemical Safety Information/World Health Organization, 2003 (WHO Food Additives Series, vol. 50) [dostęp 2021-04-06], Cytat: Overall, the epidemiological studies showed no consistently increased risk for cancer with increasing consumption of nitrate. These data, combined with the results of the epidemiological studies considered by the Committee at its forty-fourth meeting, do not provide evidence that nitrate is carcinogenic to humans..
- ↑ a b Wendy Bedale, Jeffrey J. Sindelar, Andrew L. Milkowski, Dietary nitrate and nitrite: Benefits, risks, and evolving perceptions, „Meat Science”, 120, 2016, s. 85–92, DOI: 10.1016/j.meatsci.2016.03.009 [dostęp 2021-04-06] (ang.).
- ↑ D.S. Wikoff i inni, Benefit-risk analysis for foods (BRAFO): Evaluation of exposure to dietary nitrates, „Food and Chemical Toxicology”, 120, 2018, s. 709–723, DOI: 10.1016/j.fct.2018.08.031 [dostęp 2021-04-06] (ang.).