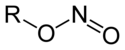Azotyny alkilowe
Azotyny alkilowe (azotany(III) alkilowe), R-ONO – organiczne związki chemiczne, estry kwasu azotawego i alkoholi.
Właściwości chemiczne
Są one odczynnikami nitrozujacymi. Stosowanymi do C-nitrozowania w pozycji alfa-ketonów, kwasów karboksylowych, nitryli, nitroalkenów oraz orto- i para-nitrotoluenów[1]. Są dość nietrwałe i rozkładają się powoli podczas przechowywania. Powinny być przechowywane w chłodnym i ciemnym miejscu. Produktami rozkładu są: woda, tlenki azotu, odpowiedni alkohol i powstający z niego aldehyd oraz produkty jego polimeryzacji[2] oraz, w przypadku azotynów drugo- i trzeciorzędowych alkoholi, alkeny. Azotyny powinny być zużyte w ciągu kilku dni, a najwyżej kilku tygodni od syntezy[3]. Azotyny alkilowe sprzedawane w sexshopach są stabilizowane antyutleniaczami, np. difenyloaminą, oraz rozcieńczane alkoholem etylowym 1:1, a następnie pakowane w ciemne butelki napełnione azotem.
Zastosowanie
Azotyny alkilowe rozszerzają naczynia krwionośne, obniżają ciśnienie krwi oraz przyśpieszają akcję serca, działają spazmolitycznie, podobnie do soli kwasu azotawego. Efekt działania utrzymuje się kilka minut. Azotyny ulegają w ustroju rozpadowi z wydzieleniem anionu azotynowego. Ich toksyczność jest również zbliżona do azotynów nieorganicznych, np. azotynu sodu[4]. W większych dawkach powodują utlenianie jonu Fe2+ w hemoglobinie do Fe3+ i powstawanie niebieskiej methemoglobiny nieprzenoszącej tlenu. Objawia się to sinieniem końców palców i ust. W przypadku utlenienia > 50% hemoglobiny następuje śmierć przez uduszenie się. Środki te stosowane są – w zależności od szybkości i czasu rozpadu w organizmie, w atakach dusznicy bolesnej oraz dychawicy oskrzelowej (azotyn amylu oraz azotyn 2-etyloheksylu) oraz w wojsku, w Indywidualnych Pakietach Przeciwchemicznych jako antidotum na zatrucie cyjanowodorem, cyjanem lub cyjankami. Mechanizm działania polega na wiązania ligandu CN– z jonem Fe3+ w powstającej methemoglobinie. azotyn amylu znajduje zastosowanie jako tzw. poppers. Azotyny alkilowe są potencjalnie rakotwórcze ze względu na możliwość nitrozowania grup aminowych do nitrozamin (dotychczas dowiedziono tego tylko w przypadku myszy[5]).
Preparatyka
Otrzymuje się je działając kwasem azotawym na odpowiedni alkohol w środowisku mocnego kwasu. Reakcja ogólna (R-OH oznacza alkohol):
- R-OH + HONO ⇌ R-ONO + H2O
Uzyskany azotyn destyluje się pod zwykłym ciśnieniem.
- Temperatury wrzenia wybranych azotynów alkilowych
- azotyn etylu: 17 °C
- azotyn butylu: 77 °C (27 °C/57,3 hPa)
- azotyn amylu (pentylu): 104 °C (29 °C/53,3 hPa)
- azotyn heksylu: 130 °C (52 °C/58,7 hPa)
Przypisy
- ↑ Jerzy Tadeusz Wróbel, Krystyna Kabzińska, Barbara Achmatowicz: Preparatyka i elementy syntezy organicznej. Warszawa: Państwowe Wydaw. Naukowe, 1983, s. 340. ISBN 83-01-02392-9.
- ↑ W. A. Noyes. n-butyl nitrite. „Organic Syntheses”. 16, s. 7, 1936. DOI: 10.15227/orgsyn.016.0007.
- ↑ Arthur Israel Vogel, Jadwiga Deles, B Furniss: Preparatyka organiczna. Warszawa: Wydawnictwa Naukowo-Techniczne, 1984, s. 347. ISBN 83-204-0579-3.
- ↑ Stanisław Rolski Chemia środków leczniczych PZWL 1968, str. 510
- ↑ Poppers: Large Cancer Increase and Immune Suppression in Animal Tests. [dostęp 2008-05-11]. [zarchiwizowane z tego adresu (2008-05-11)].