Bezwodniki kwasowe
Bezwodniki kwasowe – grupa związków chemicznych, które w wyniku praktycznej lub teoretycznej reakcji z wodą tworzą kwasy zarówno organiczne jak i nieorganiczne. Formalnie bezwodnikiem kwasowym jest cząsteczka powstająca po usunięciu dwóch atomów wodoru i jednego atomu tlenu z cząsteczki kwasu[1].
Bezwodniki kwasowe w chemii nieorganicznej
Są to tlenki kwasowe, które podczas reakcji z wodą tworzą określone kwasy.
Przykłady bezwodników:
- SO3 + H2O → H2SO4
- CO2 + H2O → H2CO3
- kwasu borowego jest tlenek boru(III):
- B2O3 + 3H2O → 2H3BO3
Bezwodnikami kwasowymi są na ogół tlenki, w których centralny atom znajduje się na tym samym stopniu utlenienia co w tworzonym kwasie. Czasami do bezwodników kwasowych zalicza się też związki tworzące z wodą kwasy beztlenowe, np. chlorowodór:
- HCl + H2O → H3O+ + Cl-
Bezwodniki kwasowe w chemii organicznej

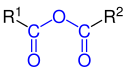
Bezwodniki kwasów karboksylowych zawierają dwie reszty kwasu połączone mostkiem tlenowym. Znane są zarówno bezwodniki symetryczne zbudowane z dwóch reszt tego samego kwasu, np. bezwodnik octowy (analogiczne struktury dla kwasów nieorganicznych nazywane są zwyczajowo kwasami piro, np. kwas pirofosforowy, popr. kwas difisforowy, H4P2O7), jak i bezwodniki mieszane, zbudowane z dwóch różnych kwasów (mogą to być dwa kwasy karboksylowe, np. bezwodnik mrówkowo-octowy CH3C(O)−O−CHO, lub kwas karboksylowy i nieorganiczny).
Kwasy monokarboksylowe nie tworzą bezwodników w wyniku dehydratacji podczas ogrzewania. Otrzymuje się je innymi sposobami, np. przez dehydratację kwasu czynnikami kondensującymi (np. DCC) lub odwadniającymi (np. tlenek fosforu(V)) lub w reakcjach kwasów lub ich soli z halogenkami kwasowymi[2]:
- CH3COCl + HCOONa → CH3C(O)−O−CHO + NaCl↓
Bezwodniki zawierające grupę acetylową można otrzymać w reakcji kwasu z ketenem:
- R−COOH + CH2=C=O → R−C(O)−O−C(O)CH3
Bezwodniki niektórych kwasów dikarboksylowych mogą powstawać w wyniku odszczepienia cząsteczki wody od cząsteczki kwasu (najczęściej pod wpływem temperatury) np. bezwodnik ftalowy z kwasu benzenodikarboksylowego czy bezwodnik bursztynowy z kwas 1,2-etanodikarboksylowego. Synteza tą metodą bezwodników kwasów dikarboksylowych prowadzi do otrzymania cyklicznych bezwodników o pierścieniach pięcio- lub sześcioczłonowych. Cykliczne bezwodniki kwasowe o większych pierścieniach nie powstają np.: bezwodnik kwasu adypinowego powinien być siedmioczłonowy jednak w wyniku ogrzewania tego kwasu w obecności Ba(OH)2 powstaje pięcioczłonowy keton - cyklopentanon oraz dwutlenek węgla i woda[3].
Bezwodnik kwasu mrówkowego
Najprostszym bezwodnikiem organicznym jest bezwodnik kwasu mrówkowego. Odwodnienie kwasu mrówkowego w zależności od warunków reakcji może prowadzić do dwóch związków:
- HCOOH - H2O → CO
- 2HCOOH - H2O → O=CH−O−CH=O
W wyniku dehydratacji kwasu mrówkowego prowadzonej wobec mocnych kwasów lub w wysokiej temperaturze powstaje tlenek węgla, CO. Związek ten nie odtwarza kwasu mrówkowego w reakcji z wodą, jednak reaguje na gorąco z NaOH z wytworzeniem mrówczanem sodu (metoda przemysłowa produkcji kwasu mrówkowego), a z alkoholanami daje mrówczany – estry kwasu mrówkowego[4].
Dehydratacja kwasu mrówkowego w łagodnych warunkach, np. wobec DCC prowadzi do powstania bezwodnika mrówkowego o wzorze O=CH−O−CH=O[5]:
- 2HCOOH + N,N'-dicykloheksylokarbodiimid → O=CH−O−CH=O + N,N'-dicykloheksylomocznik
Związek ten powstaje także w reakcji fluorku formylu z mrówczanem sodu[6] i ma właściwości oczekiwane dla bezwodników kwasów karboksylowych (reakcja z aminami do amidów[7] lub z alkoholami do estrów[8]).
Przypisy
- ↑ Loretta Jones, Peter Atkins: Chemia Ogólna - Cząsteczki, Materia, Reakcje. Wydawnictwo Naukowe PWN, 2006, s. 892. ISBN 83-01-13810-6.
- ↑ Lewis I. Krimen. Acetic formic anhydride. „Organic Syntheses”. Coll. Vol. 6, s. 8, 1988.
- ↑ Robert T. Morrison, Robert N. Boyd: Chemia Organiczna. T. 1. Warszawa: Wydawnictwo Naukowe PWN, 1997, s. 760-764. ISBN 83-01-04166-8.
- ↑ A. E. Cziczibabin: Podstawy chemii organicznej. T. 1. Warszawa: PWN, 1957, s. 269.
- ↑ G. Wu, S. Shlykov, F. S. Van Alseny, H. J. Geise, E. Sluyts, B. J. Van der Veken. Formic Anhydride in the Gas Phase, Studied by Electron Diffraction and Microwave and Infrared Spectroscopy, Supplemented with Ab-Initio Calculations of Geometries and Force Fields. „J. Phys. Chem.”. 99 (21), s. 8589–8598, 1995. DOI: 10.1021/j100021a022.
- ↑ George A. Olah, Yashwant D. Vankar; Massoud Arvanaghi; Jean Sommer. Formic Anhydride. „Angewandte Chemie Int. Ed. Engl.”. 18 (8), s. 614, 1979. DOI: 10.1002/anie.197906141.
- ↑ Yong-Huang Chen, J. William Lown. A New DNA Minor Groove Binding Motif: Cross-Linked Lexitropsins. „J. Am. Chem. Soc.”. 116 (16), s. 6995–7005, 1994. DOI: 10.1021/ja00095a001.
- ↑ Andre Hallot, Roger Brodin, Josiane Merlier, Joelle Brochard, Jean Pierre Chambon, Kathleen Biziere. Synthesis and activity of 6-aryl-3-(hydroxypolymethyleneamino)pyridazines in animal models of epilepsy. „J. Med. Chem.”. 29 (3), s. 369–375, 1986. DOI: 10.1021/jm00153a011.
Media użyte na tej stronie
Autor: Daniel Dróżdż, Licencja: CC BY 4.0
Chloroacetic anhydride in a glass container, Faculty of Chemistry, University of Wrocław
Structure of Carboxylic anhydride