Białko C
| |||
| Identyfikacja | |||
| OMIM | 612283 | ||
|---|---|---|---|
| HomoloGene | 37288 | ||
| Genetyka i fizjologia | |||
| Locus | 2q14.3 | ||
Białko C – jedno z białek, występujących we krwi, których zadaniem jest przeciwdziałanie procesowi krzepnięcia krwi. Należy do białek zależnych od witaminy K. Kodowane jest przez gen PROC zlokalizowany na chromosomie 2 (2q13-q14)[1][2]. Pod względem biochemicznym jest proteazą serynową, która w formie aktywnej degraduje aktywny czynnik V (przy współudziale heparyny) i aktywny czynnik VIII (przy współudziale białka S)[3][4]. Mutacja Leiden genu czynnika V prowadzi do powstania białka odpornego na działanie białka C[5] co zwiększa ryzyko wystąpienia powikłań zakrzepowo-zatorowych.
W osoczu białko C występuje głównie w formie nieaktywnej. Aktywacja białka C następuje na powierzchni komórek śródbłonka naczyń przy udziale: śródbłonkowego receptora białka C, trombiny i trombomoduliny[6].
Niedobór białka C
Wrodzony niedobór białka C (OMIM+176860) powoduje skłonność do występowania zakrzepicy naczyń, zwłaszcza żylnych, oraz według niektórych publikacji nawykowych poronień[7][8][9][10]. W przypadku całkowitego braku białka C, lub mutacji skutkujących wytwarzaniem patologicznych form białka dochodzi do rozwoju zespołu wykrzepiania śródnaczyniowego i plamicy piorunującej u noworodków[6].
Z nabytym niedoborem białka C spotkać się można w przypadku niedoboru witaminy K, rozsianego wykrzepiania śródnaczyniowego, sepsy, uszkodzenia wątroby, podczas leczenia warfaryną i L-asparaginazą[11][12][13][14][15].
Białko C u chorych z sepsą
W przypadku sepsy dochodzi do upośledzenia procesu aktywacji białka C spowodowanego zniszczeniem komórek śródbłonka i brakiem trombomoduliny. O ile w przypadku DIC wystarcza podanie nieaktywnej formy białka C aby zahamować proces wykrzepiania (np. w patologii ciąży) o tyle w przypadku sepsy takie działanie nie przyniesie efektu. W sepsie należy podawać preparaty aktywowanego białka C. Preparat rekombinowanego aktywowanego białka C (rAPC, drotrecogin alpha, Xigris firmy Ely Lilly Co) otrzymał rekomendację do stosowania w przypadkach ciężkiej sepsy i wstrząsu septycznego na podstawie badania PROWESS[16]. Opinie niektórych naukowców budzą wątpliwości co do prawidłowości przeprowadzenia badania i wniosków z niego wypływających, a wyniki niektórych innych badań klinicznych nie potwierdzają skuteczności aktywowanego białka C w leczeniu sepsy[17][18][19][20][21][22][23]. W publikacjach zwraca się uwagę na potrzebę dalszych prób klinicznych[18][22].
Drotrecogin alpha znalazł natomiast pewne zastosowanie w leczeniu zakażeń wirusem gorączki krwotocznej Ebola[24].
Powikłania leczenia związane są z mechanizmem działania aktywnego białka C. Obejmują przede wszystkim powikłania krwotoczne, w wielu przypadkach mogące przyczynić się do śmierci chorego[25][26][27]. Spowodowane leczeniem krwawienia śródczaszkowe często pojawiają się już w okresie poprawy stanu zdrowia pacjenta, niwecząc całe postępowanie medyczne. Z tego powodu w wielu przypadkach chorych do leczenia aktywnym białkiem C kwalifikuje się z dużą ostrożnością. Na terenie Unii Europejskiej lek dopuszczony jest do stosowania warunkowo[27].
W 2008 roku koszt terapii rekombinowanym aktywowanym białkiem C w Polsce wynosił około 50 tysięcy PLN[28].
Przypisy
- ↑ PROC - protein C (inactivator of coagulation factors Va and VIIIa) - Genetics Home Reference. [dostęp 2010-02-11]. [zarchiwizowane z tego adresu (2010-03-05)].
- ↑ P. Patracchini, V. Aiello, P. Palazzi, E. Calzolari i inni. Sublocalization of the human protein C gene on chromosome 2q13-q14.. „Hum Genet”. 81 (2), s. 191-2, Jan 1989. PMID: 2912888.
- ↑ Gerd. Herold: Medycyna wewnętrzna : repetytorium dla studentów medycyny i lekarzy. Warszawa: Wydawnictwo Lekarskie PZWL, 2001, s. 118. ISBN 83-200-2588-5.
- ↑ Indeks leków Medycyny Praktycznej 2007. Kraków: Wydawnictwo Medycyna Praktyczna, 2007, s. 204. ISBN 978-83-7430-110-7.
- ↑ OMIM - COAGULATION FACTOR V; F5. [dostęp 2010-02-12].
- ↑ a b SL. Pescatore. Clinical management of protein C deficiency.. „Expert Opin Pharmacother”. 2 (3), s. 431-9, Mar 2001. DOI: 10.1517/14656566.2.3.431. PMID: 11336597.
- ↑ CF. Allaart, SR. Poort, FR. Rosendaal, PH. Reitsma i inni. Increased risk of venous thrombosis in carriers of hereditary protein C deficiency defect.. „Lancet”. 341 (8838), s. 134-8, Jan 1993. PMID: 8093743.
- ↑ KS. Song, HK. Kim, JW. Song, JR. Choi i inni. A novel silent substitution (C8516T) in exon 9 of the human PROC gene.. „Yonsei Med J”. 42 (3), s. 364-6, Jun 2001. PMID: 11456407.
- ↑ JL. Brouwer, NJ. Veeger, HC. Kluin-Nelemans, J. van der Meer. The pathogenesis of venous thromboembolism: evidence for multiple interrelated causes.. „Ann Intern Med”. 145 (11), s. 807-15, Dec 2006. PMID: 17146065.
- ↑ M. Sugiura. Pregnancy and delivery in protein C-deficiency.. „Curr Drug Targets”. 6 (5), s. 577-83, Aug 2005. PMID: 16026278.
- ↑ PN. Knoebl. Human protein C concentrates for replacement therapy in congenital and acquired protein C deficiency.. „Drugs Today (Barc)”. 44 (6), s. 429-41, Jun 2008. DOI: 10.1358/dot.2008.44.6.1217993. PMID: 18596997.
- ↑ CL. Gladson, P. Groncy, JH. Griffin. Coumarin necrosis, neonatal purpura fulminans, and protein C deficiency.. „Arch Dermatol”. 123 (12), s. 1701a-1706a, Dec 1987. PMID: 2961308.
- ↑ Protein C Deficiency: eMedicine Hematology. [dostęp 2010-02-12].
- ↑ F. Mielot, P. Danel, C. Boyer, L. Coulombel i inni. [Acquired deficiencies in antithrombin III and C protein during treatment with L-asparaginase]. „Arch Fr Pediatr”. 44 (3), s. 161-5, Mar 1987. PMID: 2883953.
- ↑ MC. Guillin, A. Bezeaud. [Protein C, protein S]. „Ann Biol Clin (Paris)”. 45 (2), s. 184-90, 1987. PMID: 3039876.
- ↑ GR. Bernard, JL. Vincent, PF. Laterre, SP. LaRosa i inni. Efficacy and safety of recombinant human activated protein C for severe sepsis.. „N Engl J Med”. 344 (10), s. 699–709, Mar 2001. PMID: 11236773.
- ↑ Jacek Jastrzębski: Skuteczność i bezpieczeństwo stosowania rekombinowanego ludzkiego aktywowanego białka C w leczeniu ciężkiej posocznicy – badanie PROWESS – komentarz do artykułu. [dostęp 2010-01-08].
- ↑ a b M. Levi. Activated protein C in sepsis: a critical review.. „Curr Opin Hematol”. 15 (5), s. 481–6, Sep 2008. DOI: 10.1097/MOH.0b013e328304b3e3. PMID: 18695371.
- ↑ D. Poole, G. Bertolini, S. Garattini. Errors in the approval process and post-marketing evaluation of drotrecogin alfa (activated) for the treatment of severe sepsis.. „Lancet Infect Dis”. 9 (1), s. 67–72, Jan 2009. DOI: 10.1016/S1473-3099(08)70306-2. PMID: 19095197.
- ↑ PF. Laterre. Clinical trials in severe sepsis with drotrecogin alfa (activated).. „Crit Care”. 11 Suppl 5, s. S5, 2007. DOI: 10.1186/cc6156. PMID: 18269692.
- ↑ G. Houston, BH. Cuthbertson. Activated protein C for the treatment of severe sepsis.. „Clin Microbiol Infect”. 15 (4), s. 319–24, Apr 2009. DOI: 10.1111/j.1469-0691.2009.02751.x. PMID: 19416303.
- ↑ a b JO. Friedrich, NK. Adhikari, MO. Meade. Drotrecogin alfa (activated): does current evidence support treatment for any patients with severe sepsis?. „Crit Care”. 10 (3), s. 145, 2006. DOI: 10.1186/cc4947. PMID: 16762040.
- ↑ Rekomendacja Rady Konsultacyjnej dotycząca finansowania drotrekoginy alfa (Xigris®) w leczeniu ciężkiej posocznicy (pol.). Agencja Oceny Technologii Medycznych. [dostęp 2010-01-09].
- ↑ Ryszard Korbut (pod red.): Farmakologia. Warszawa: PZWL, 2017, s. 475. ISBN 978-83-200-5368-5.
- ↑ CA. Gentry, KB. Gross, B. Sud, DA. Drevets. Adverse outcomes associated with the use of drotrecogin alfa (activated) in patients with severe sepsis and baseline bleeding precautions.. „Crit Care Med”. 37 (1), s. 19-25, Jan 2009. DOI: 10.1097/CCM.0b013e318192843b. PMID: 19050637.
- ↑ Early Communication about an Ongoing Safety Review Xigris (Drotrecogin alfa [activated)]. FDA. [dostęp 2010-01-09].
- ↑ a b Charakterystyka produktu leczniczego (pol.). EMEA. [dostęp 2010-01-09].
- ↑ Osocze skażone korupcją- Onet.pl - Wiadomości -20.02.2008. [dostęp 2010-02-11].
Linki zewnętrzne
- PROTEIN C DEFICIENCY, CONGENITAL THROMBOTIC DISEASE DUE TO w bazie Online Mendelian Inheritance in Man (ang.)
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Emw, Licencja: CC BY-SA 3.0
Structure of the PROC protein. Based on PyMOL rendering of PDB 1aut.
(c) I, Mrug, CC-BY-SA-3.0
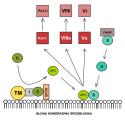
Działanie antykoagulacyjne białka C.
TM - trombomodulina
T - trombina
C - białko C
S - białko S
APC - aktywowane białko C
EPCR - receptor białka C
C4bBP - białko wiążące białko S
Va - aktywny czynnik V
Vi - nieaktywny czynnik V
VIIIa - aktywny czynnik VIII
VIIIi - nieaktywny czynnik VIII
PAI-1 - inhibitor aktywatora plazminogenu 1
PAI-1i - nieaktywny inhibitor aktywatora plazminogenu 1