Biochemia zapylania

Biochemia zapylania – interdyscyplinarna dziedzina nauk biologicznych, dotycząca biochemicznych mechanizmów rozmnażania się roślin nasiennych (kwiatowych) z udziałem zapylaczy (głównie owadów), leżąca na pograniczu botaniki, zoologii, chemii i ekologii.
Analizując międzygatunkowe oddziaływania (często mutualistyczne) między zapylaczami i roślinami bierze się pod uwagę takie czynniki biochemiczne, jak zapach kwiatów i ich barwa oraz smak i wartość energetyczna nektaru i pyłku. Efektywność takiej obustronnie korzystnej interakcji między rośliną i zapylaczem zależy również od wrażliwości zmysłów zapylacza – węchu i wzroku – oraz od cech morfologicznych obu partnerów (np. wielkość i kształt kwiatu, wielkość i budowa aparatu gębowego owada lub innego zapylacza). Istotny jest również wpływ zmiennych w przestrzeni i czasie czynników ekologicznych – abiotycznych i biotycznych – które mogą powodować m.in. niekorzystne zmiany liczebności obu współistniejących populacji.
Elementy historii kwiatów i owadów
Powszechnie uznaje się, że pierwsze interakcje między roślinami kwiatowymi i owadami – niezwykle efektywny mechanizm reprodukcyjny, który przyspieszył tempo specjacji obu grup gatunków – pojawiły się w okresie kredy (145–66 mln lat temu)[1][2]. Nastąpiło to po wielu wcześniejszych etapach rozwoju życia na Ziemi, poczynając od prekambru (4567,17–541 mln lat temu; zob. tabela stratygraficzna)[3][4].
Z prekambru pochodzą ślady życia archeanów, bakterii, sinic (stromatolity) oraz pierwszych eukariontów. Prawdopodobnie ok. 700 mln lat temu pojawiły się pierwsze organizmy wielokomórkowe, a ok. 650 mln lat temu – m.in. fauna ediakarańska, jamochłony, wiciowce, zielenice. W kambrze (541–485,4 mln lat temu) – okresie kambryjskiej eksplozji fauny – florę reprezentowały grzyby, glony i porosty. W ordowiku (485,4–443,4 mln lat temu) pojawiły się prawdopodobnie pierwsze grzyby i rośliny lądowe (zob. psylofity, rośliny telomowe, ryniofity, kuksonia), a w sylurze (443,4–419,2 mln lat temu) na nieprzyjaznych dla roślin lądach, tylko gdzieniegdzie pokrytych cienką warstwą gleby, pojawiły się rośliny naczyniowe, początkowo związane z gruntem chwytnikami, a później korzeniami, wytwarzające drewno, łyko, liście. Zasiedlanie odległych od bagnistych wybrzeży części lądów stało się możliwe dzięki roślinom, które zaczęły wytwarzać osłonięte zarodniki, przenoszone przez wiatr (anemochoria)[2][3][4].
Skamieniałości zawierające ślady życia pierwszych owadów nie umożliwiają jednoznacznego określenia przebiegu ich ewolucji, jednak przypuszcza się, że pojawiły się w sylurze (najstarsza skamieniałość nie budząca wątpliwości pochodzi sprzed ok. 396 mln lat, z osadów dewońskich)[5][6]. Wówczas zaczęło się rozwijać oddziaływanie roślin nasiennych z owadami, związane z wzajemnymi dostosowaniami drogą doboru naturalnego – darwinowskim „fitness”, zwiększającym ewolucyjny sukces obu grup gatunków[7][8][2].
Ślady tych zjawisk, zachowane w postaci skamieniałości, nie dostarczają informacji o ich biochemicznych mechanizmach, np.:
- o barwach kwiatów (barwniki roślinne) i cechach wzroku ówczesnych zapylaczy (w tym budowa fotoreceptorów i preferencje barw),
- o stereochemicznych cechach stosowanych przez rośliny atraktantów – bodźców chemicznych (zob. substancje semiochemiczne), dostosowanych do możliwości percepcji zapachu i smaku przez przedstawicieli wabionych zapylaczy (np. skład chemiczny i zapach olejków eterycznych, skład chemiczny i smak nektaru kwiatów).
jura późna
Zapylacze we współczesnych ekosystemach
Współczesne interakcje między roślinami kwiatowymi i zapylaczami ukształtowały się w epoce holocenu. Są jednym z mechanizmów działania ekosystemów, które decydują o ich dzisiejszej strukturze. Procesy zachodzące w tych systemach są przedmiotem badań zoologów, botaników, ekologów, biochemików, którzy opisują poszczególne elementy biosfery, obserwując je z różnych punktów widzenia i stosując nieustannie doskonalone specjalistyczne techniki badawcze.
Rodzaje istniejących współcześnie interakcji między roślinami i zwierzętami są zależne od stref klimatycznych, w których znajdują swoje nisze różne gatunki. W strefie klimatów umiarkowanych powszechnie występującymi zapylaczami są owady (owadopylność), aktywne głównie w ciągu dnia. Są to przede wszystkim trzmiele i pszczoły miodne, lecz również np. małe muchówki lub pchełki. W krajach strefy tropikalnej funkcję zapylaczy pełni wiele dużych tropikalnych motyli i chrząszczy, kolibry (ornitogamia), drobne gryzonie, ślimaki (malakogamia)[10].
Niektóre z owadów odwiedzających kwiaty i korzystających z nektaru i pyłku nie uczestniczą w zapylaniu. Przykładem są mrówki, nie wchodzące w symbiozę z roślinami. Wzajemnie korzystne trwałe interakcje utrudnia fakt, że wydzielina mrówek zawiera związki bakteriobójcze i grzybobójcze, które są szkodliwe dla pyłku. W Australii zaobserwowano dwa wyjątki od tej zasady. Istnieje gatunek mrówek, którego osobniki nie wytwarzają antybiotyków,a także kilka gatunków storczyków, które są zapylane przez mrówki w czasie ich lotów godowych, ponieważ w tym okresie wytwarzają związki neutralizujące ich wydzielinę[11].
Koewolucja[12] kwiatów i zapylaczy to różnorodne wzajemne dostosowania gatunków zajmujących to samo środowisko (darwinowskie „fitness”). Proces doprowadził do powstania wielu obustronnie korzystnych interakcji roślin kwiatowych z przedstawicielami różnych gatunków zapylaczy (np. silny mutualizm w układzie pełnik europejski-muchówki z rodzaju Chiastocheta).
Dostosowania zachodzą drogą doboru naturalnego. Ich efektem są np. zmiany kształtu kwiatów, z równoległymi zmianami budowy aparatów gębowych owadów lub kształtu dziobów ptaków, zmiany barwy kwiatów i zapachu olejków eterycznych, z równoległymi zmianami wrażliwości węchu i wzroku zapylaczy (zob. ewolucja widzenia barwnego).
Wykazano, że kwiaty zapylane przez zwierzęta (zoogamia) charakteryzuje niezmienność cech ustalonych w wyniku koewolucji z zapylaczem. Stałość morfologicznych cech kwiatów, ich barwy i zapachu sprzyja „wierności partnerów” interakcji. W wielu przypadkach rośliny mogą być zapylane np. przez owady bardzo nielicznych gatunków albo nawet przez osobniki tylko jednego gatunku. Z drugiej strony część owadów jest dostosowana do korzystania z nektaru i pyłku kwiatów, które należą do nielicznych gatunków roślin (lub tylko jednego gatunku). Przykłady wybitnego wzajemnego uzależnienia dwóch gatunków zaobserwowano w przypadku figowców o kwiatach zapylanych przez osowate – prawie każdy gatunek rośliny ma „własnego” zapylacza. Podobnie ścisłe uzależnienia występują wśród storczykowatych[13]. Kilka innych przykładów interakcji roślin z zapylaczami zestawiono w tabeli[14].
| Roślina (rodzina i gatunek) | Dominujące zapylacze | Biochemiczne cechy interakcji |
| Delphinium nelsonii, Ranunculaceae | trzmiele, kolibry | wymagana niebieska barwa kwiatów (białe mutanty nie są zapylane) |
| Rechsteineria macrorhiza, Gesneriaceae | kolibry | kwiaty szkarłatnopomarańczowe dzięki dezoksyantocyjanidynie |
| Ipomopsis aggregata, Polomoniaceae | kolibry, zawisaki | barwa zmienna (od czerwonej do białej), zależna od rodzaju zapylacza |
| Rudbeckia hirta, Compositae | pszczoły | wydajność zapylania zwiększają wzory absorbujące UV (efekt obecności patuletyny) |
| Arum maculatum, Araceae | muchy gnojówki | zapach uwalnianego skatolu przywabia muchy (z dala od pryzm obornika) |
| Datura inoxia, Solanaceae | zawisaki | obecność w nektarze alkaloidów, działających na zapylacze narkotycznie |
| gatunki Ophrys, Orchidaceae | samce pszczoły Andrena | kształt, barwa i zapach kwiatów przypomina samice |
| gatunki Catasetum, Orchidaceae | samce pszczoły Eluaema | samce gromadzą substancje zapachowe, które potem odgrywają rolę feromonów (tworzenie rojów godowych) |
| Calceolaria pavoni, Scrophulariaceae | pszczoły samotnice | zawierający lipidy wysokoenergetyczny nektar jest zbierany przez samice i używany do karmienia larw |
| gatunki Passiflora, Passifloraceae | motyle górskie | nektar o zwiększonej zawartości azotu po zmieszaniu z pyłkiem |
Elementy ekologii biochemicznej zapylania
Barwa kwiatów i wzrok zwierząt
Wzrok zwierząt umożliwia im odbieranie od roślin bodźców – sygnałów dotyczących barwy i kształtu kwiatów.
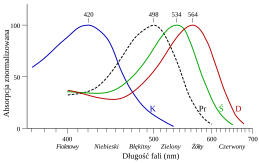
Barwa kwiatów jest ważną informacją, przekazywaną zapylaczom w formie światła widzialnego dla człowieka (promieniowania elektromagnetycznego o długościach fal ok. 380–780 nm, na które reagują czopki siatkówki oka) lub w zakresie ultrafioletu (na promieniowanie o tych długościach fali reaguje wzrok części zwierząt). Promieniowanie docierające do oka obserwatora jest tą częścią promieniowania słonecznego (dziennego światła białego), która nie została zaabsorbowana przez obserwowany obiekt, np. płatki kwiatów (została od nich odbita). Różnica między widmem promieniowania padającego i odbitego od płatka kwiatu zależy od zawartości w nim związków chemicznych, które absorbują promieniowanie (barwniki). Obserwator dostrzega barwę, jeżeli energia kwantów absorbowanej części promieniowania odpowiada zakresowi wrażliwości receptorów narządu wzroku[15][16][17].
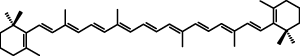
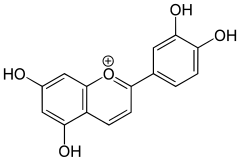
Związkami odpowiedzialnymi za barwę kwiatów są przede wszystkim flawonoidy – liczna grupa związków obecnych w chromoplastach lub wakuolach, odpowiedzialnych za barwę pomarańczową, czerwoną, niebieską, żółtą i białą. Poza flawonoidami pewną rolę odgrywają karotenoidy (żółte, odcienie czerwone i pomarańczowe). Stosunkowo niewielkie znaczenie mają inne rodzaje barwników naturalnych oraz zielone chlorofile[18].
Najbardziej powszechne są flawonoidy nazywane antocyjanidynami (zob. wzory poniżej, przykład po lewej stronie zestawienia). Poszczególne związki nie występują in vivo w postaci wolnej, lecz np. metylowanej lub glikozydowej – z resztami cukrowymi przyłączonymi np. w różnych pozycjach podstawowej struktury flawonoidów. Wskutek podstawienia zmienia się widmo absorpcyjne związku (przesuwa się pasmo absorpcji). Podobne efekty wywołuje powstawanie kopigmentów – kompleksów wewnątrz- lub międzycząsteczkowych i inne oddziaływania (np. powstawanie kompleksów z udziałem jonów metali)[19].
po lewej – antocyjanidyna (zob. flawonoidy),
powyżej – β-karoten (zob. karotenoidy),
po prawej – struktura porfiryny (zob. chlorofile)
Trzy najbardziej powszechne flawonoidy (zob. wzory powyżej, przykład po lewej stronie), antocyjanidyny, są pochodnymi, w których[20]:
a symbole R1 i R3 oznaczają[20]:
- – pomarańczowoczerwona pelargonidyna (Pg, 510 nm[a]), kwiaty różowe, szkarłatne i pomarańczowoczerwone,
- – purpurowa cyjanidyna (Cy, 525 nm), kwiaty karmazynowe i purpurowe,
- – fiołkoworóżowa delfinidyna (Dp, 535 nm), kwiaty bladoniebieskie i niebieskie.
- – purpurowa cyjanidyna (Cy, 525 nm), kwiaty karmazynowe i purpurowe,
Zdarzająca się w niektórych kwiatach utrata grupy hydroksylowej R4 powoduje przesunięcie barwy w kierunku fal krótszych (zob. luteolinidyna, 3-dezoksyantocyjanidyny).
W procesie ewolucji rola poszczególnych barwników roślinnych w środowisku ulegała zmianom. Uważa się, że barwnikiem najbardziej biosyntetycznie prymitywnym jest cyjanidyna (występująca u roślin nagonasiennych, wiatropylnych przodków roślin okrytozalążkowych), a pelargonidyna i delfinidyna są bardziej zaawansowane. Tego typu wnioski są wyciągane na podstawie badań częstości występowania Cy, Pd, i Dp w roślinach różnych stref klimatycznych. Pelargonidyna występuje przede wszystkim w roślinach tropikalnych, 3-dezoksyantocyjanidyny (np. luteolinidyna) – wyłącznie w gatunkach tropikalnych (np. ostrojowate i bignoniowate)[21].
Badania z dziedziny biochemii zapylania obejmują określanie udziałów Cy, Pd, i Dp w różnych zbiorowiskach roślinnych. Stwierdzono np. że udziały wynoszą we florze[22]:
- Australii: 47% Cy, 2% Pd, 63% Dp
- Indii Zachodnich: 70% Cy, 17% Pd, 47% Dp
Różnica między tymi zbiorowiskami jest wyjaśniana różnym udziałem ptaków i owadów, preferujących różne barwy w procesie zapylania (mała rola Pd w Australii jest wiązana z niewielką liczbą zapylających ptaków).
| Zapylacze | Barwy | Uwagi |
| nietoperze | białe, brunatne, zielonobrunatne, bladopurpurowe | przeważnie nie widzą barw |
| pszczoły | żółte, intensywnie niebieskie, białe | niewrażliwe na czerwień, widzą w UV |
| żuki | przyćmione kremowe, zielonkawe | mało wrażliwe na barwy |
| ptaki | żywe szkarłatne, dwubarwne – czerwono-żółte | wrażliwe na czerwień |
| motyle (Rhopalocera) | różne żywe, w tym czerwone i purpurowe | |
| ćmy (Heterocera) | czerwone i purpurowe, białe, bladoróżowe | aktywne głównie nocą |
| muszki | przyćmione brązowe, purpurowe lub zielone | możliwe wzory szachownicy |
| myszy | białawe środki, przylistki ciemnoczerwone | aktywne nocą |
Ewolucyjne zmiany barwy kwiatów w zbiorowiskach roślinnych następują stosunkowo szybko. Stwierdzono, że niekiedy rośliny zmieniają barwę kwiatów w ciągu jednego lub dwóch pokoleń, adaptując się do zmiany udziałów zapylaczy preferujących różne barwy[22]. Kwiaty Ipomopsis aggregata rosnące w Arizonie w pobliżu Flaggstaff zmieniają barwę nawet w czasie jednego sezonu wegetacyjnego. Ich barwa zmienia się z czerwonej na białą poprzez różne odcienie różowej (stopniowe wyłączanie syntezy antocyjanin w płatkach). Termin tej zmiany jest skorelowany z datą odlotu na południe zapylających kwiaty kolibrów, których funkcje przejmują wówczas zawisaki Hyles lineata. Zmiana barwy kwiatów bywa również wykorzystywana jako sygnał kierujący zapylacze przede wszystkim do kwiatów jeszcze niezapylonych. W kwiatach Lantana camara (lantana pospolita) po zabraniu przez owada nektaru z żółtego kwiatu (barwnik: karotenoidy) następuje zmiana barwy na czerwoną (barwnik: antocyjanina). Dzięki takiemu współdziałaniu dochodzi do szybszego zapylenia wszystkich kwiatów (korzyść rośliny), a owady szybciej odnajdują kwiaty jeszcze zawierające nektar. Analogiczne dostosowania zaobserwowano w latach 1987–1991 w co najmniej 74 rodzinach roślin okrytozalążkowych (biochemiczny mechanizm zmian do roku 1997 nie został rozpoznany)[24].
W wielu kwiatach funkcja barwników nie ogranicza się do wabienia zapylaczy z dalszych odległości. Liczne barwne wzory odgrywają również rolę „znaków drogowych”, wskazujących owadom (najbardziej wyraźnie – pszczołom) miejsca lokalizacji organów płciowych i nektaru. Znaki przybierają formę plam o większej intensywności barwy tego samego barwnika (np. cyjanidyny w dzwonkach naparstnicy purpurowej) albo wyraźniejszych pasków lub plamek (np. brodawki barwnikowe o innym odcieniu). Niektóre z kwiatów zawierają wskaźniki nektaru niewidoczne dla oka ludzkiego. Żółte płatki „Czarnookiej Zuzanny” (Rudbeckia hirta, zob. rodzaj rudbekia), wabiące owady z dużej odległości, zawierają dodatkowo inny żółty barwnik (z grupy flawonoidów), który absorbuje również UV. Jest on skoncentrowany wokół miejsca lokalizacji nektaru i wskazuje to miejsce pszczołom, widzącym w tym zakresie długości fal. Analogiczne wskaźniki nektaru, niewidzialne dla człowieka, występują również w kwiatach białych[25].
Koncentracja uwagi na zagadnieniach percepcji barwy sprawia, że pomijany bywa aspekt dotyczący rozpoznawania kształtu kwiatów. Przykładem roli tej funkcji wzroku są interakcje między niektórymi gatunkami storczykowatych a zapylającymi je pszczolinkami. Badania dotyczyły m.in. zachowań dzikich pszczolinek (Andrena), które zapylają nie wytwarzające nektaru storczyki z rodzaju dwulistnik (Ophrys). W zapylaniu uczestniczą wyłącznie samce pszczolinek, wykonujące na kwiatach tzw. „pseudokopulację”. Ewolucyjne dostosowanie rośliny do interakcji z owadami polegało na upodobnieniu wyglądu kwiatów (barwa i kształt) do wyglądu samic. Stwierdzono też, że olejki eteryczne dwulistników zawierają składniki stereochemicznie odpowiadające feromonom, wyodrębnionym z gruczołów płciowych samic pszczolinek (roślina wabi owady wyglądem i zapachem)[26].
Węch, zapach kwiatów i feromony owadów
Odpowiedzi na pytania o biochemiczne podstawy działania zmysłu węchu poszukiwano od stuleci, jednak znaczący postęp w tej dziedzinie zanotowano dopiero w końcu XX w. (zob. Linda B. Buck, Richard Axel, Nagroda Nobla w dziedzinie fizjologii lub medycyny w roku 2004). Stwierdzono, że wykrywanie cząsteczek odorantów zachodzi z udziałem receptorów węchowych (OR od ang. Olfactory Receptor), należących do rodziny rodopsynopodobnych receptorów klasy A sprzężonych z białkami G[27], które znajdują się w błonie komórkowej neuronów receptorowych węchu[28]. Pobudzenie tych neuronów jest pierwszym etapem przewodzenia sygnału nerwowego do wyższych pięter układu nerwowego (np. do mózgu człowieka)[29].
Neurony z receptorami OR znajdują się np. wśród komórek nabłonka węchowego nosa, w różnej liczbie u różnych gatunków zwierząt (różnica dotyczy zarówno liczby rodzajów OR, jak ogólnej liczby neuronów nabłonka). U owadów receptory OR są zlokalizowane w ich czułkach – „antenach” wyspecjalizowanych w odbieraniu określonych zapachów, np. feromonów. Wiedza o mechanizmach rozpoznawania zapachu mieszanin odorantów jest dotychczas niepełna.

Reakcja bioczujnika jest zależna od rodzaju odoranta i jego stężenia w powietrzu.
Dozowanie – np. pipeta Pasteura, zawierająca bibułę z odorantem (np. kropla 1% parafinowego roztworu feromonu)[30] lub wylot gazu z chromatografu gazowego (kolejne eluaty z kolumny GC)[31]
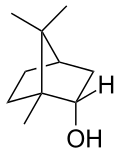
Również chemiczny skład mieszanin substancji zapachowych, wytwarzanych w kwiatach różnych roślin, nie został ostatecznie poznany. W skład olejków eterycznych wchodzą liczne związki chemiczne – związki aromatyczne i alifatyczne, monoterpeny, seskwiterpeny (m.in. anetol, azuleny, borneol, cytral, egzaltolid, eugenol, farnezol, geraniol, indol, jasmon, kamfen, karwon, linalol, mentol, menton, nerol, α-pinen, salicylan metylu, tymol i wiele innych)[32][33].
Ilościowe proporcje między składnikami olejków eterycznych zależą od gatunku rośliny i części poszczególnych roślin (np. kwiaty, liście, łodygi). W ramach gatunku są zmienne w przestrzeni i czasie (utrudnia to utrzymanie efektywnej interakcji z zapylaczami, jeżeli nie są dostosowane do tych zmian). Zależą od warunków środowiska, m.in. takich czynników, jak nasłonecznienie lub pH i inne cechy gleby. Poniżej zamieszczono przykładowe zestawienie niektórych cech olejku goździkowego[34].
| Właściwości | Olejek z pączków | Olejek z szypułek | Olejek z liści |
| Przeciętna wydajność | 16–19% (Zanzibar) | 5,5% |
|
| Główne składniki | eugenol i acetyloeugenol (łącznie 78–95%) | eugenol (83–95%), brak albo bardzo małe ilości acetyloeugenolu. | eugenol, zawartość:
|
| Zapach | silnie korzenny | mniej przyjemny niż olejku z pączków | mniej przyjemny niż olejku z szypułek |
Najwięcej uwagi poświęcano badaniom składu olejków o zapachu przyjemnym dla ludzi, np. wykorzystywanych do produkcji perfum lub aromatów spożywczych, podczas gdy rośliny wabiące owady często wydzielają lotne związki pachnące nieprzyjemnie. Należą do nich np. barszcz zwyczajny (Harecleum sphondylium), ciemiernik cuchnący (Helleborus foetidus) i obrazki plamiste (Arum maculatum L.). Uwalnianie do środowiska takich substancji jest konsekwencją koewolucji roślin z owadami żerującymi na gnojowicy, oborniku, odpadach komunalnych lub padlinie. Nieprzyjemny dla ludzi zapach wabi również aktywne nocą ćmy i nietoperze[35].
W tej grupie związków wymienia się np. tiole, tioetery i inne związki siarkoorganiczne (często o zapachu przypominającym zepsute jaja, cebulę lub czosnek) oraz związki azotu, np. metyloamina, etyloamina, propyloamina, putrescyna, kadaweryna, indol, skatol i inne (zapach rybi lub zapach kału)[35].
Kwiaty takich roślin, jak np. Arum nigrum i Arum maculatum (zob. też pałczycha) uwalniają lotne związki o zapachu kału, wabiące żuki gnojowe i muchy (uwalnianiu się odorantów sprzyja podgrzewanie wnętrza pochwy kwiatostanu w wyniku wykorzystania alternatywnej drogi oddechowej). Zwabione owady spadają do wnętrza pochwy, której wewnętrzne ścianki są pokryte oleistą wydzieliną. Próbując – przez ok. 24 godziny – wydostać się z pułapki, przenoszą pyłek na kwiaty żeńskie. W niektórych mieszaninach emitowanych przez część kwiatów bywają identyfikowane dodatkowo związki o działaniu narkotycznym lub usypiającym, co zwiększa prawdopodobieństwo efektywnego wykorzystania schwytanego zapylacza[35].
Z podobnych metod chwytania owadów korzysta człowiek, np. ustawiając w sadach pułapki feromonowe. W części z nich jest stosowany ester metylowy eugenolu – związek bardzo skutecznie wabiący samce orientalnej muszki owocowej Dacus dorsalis. Jest on zarówno feromonem płciowym tych owadów, jak atraktantem wytwarzanym przez kwiatostany i liście Cassia fistulosa (Leguminosae) oraz kilku innych roślin[b][35].
O podobnym zjawisku wspomniano wcześniej, opisując przypadek przywabiania samców dzikich pszczolinek (Andrena) do kwiatów storczyka z rodzaju dwulistnik (Ophrys), które nie wytwarzają nektaru. W skład wabiących substancji zapachowych Ophrys wchodzą krótkołańcuchowe związki alifatyczne, monoterpeny i dwupierścieniowe seskwiterpeny z serii kadinenu (te same związki zidentyfikowano w ekstrakcie z gruczołów płciowych samic pszczolinek)[36].
Nektar
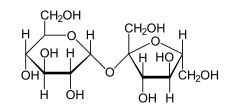
Wabienie zapylaczy jest jedynym celem wytwarzania nektaru przez rośliny. Jest on wykorzystywany przez wiele gatunków zwierząt (nie tylko zapylacze); dla niektórych jest jedynym źródłem pożywienia, np. dla imago motyli. Nektary są zwykle roztworami cukrów (15–75% suchej masy), w tym[37]:
- zwykle – glukoza, fruktoza i sacharoza (podstawowe cukry metabolizmu roślinnego),
- często – śladowe ilości oligosacharydów (np. rafinoza),
- czasami – maltoza, trehaloza, melezitoza.
Wykazano istnienie wielkiego zróżnicowania względnych udziałów trzech podstawowych cukrów pomiędzy gatunkami roślin okrytonasiennych (badania, wykonane w roku 1960, obejmowały 900 gatunków), jednak udziały te są wybitnie stałe, niezależne od pory dnia, sezonu lub wieku rośliny. Porównując gatunkowy skład 3 grup roślin, w których nektarze[38]:
- dominuje sacharoza,
- udziały wszystkich trzech związków są podobne,
- zawartość sacharozy jest mniejsza, niż pozostałych dwóch,
prawdopodobnie na początku ewolucji okrytonasiennych ich nektar zawierał głównie sacharozę. Nowe gatunki, o zmniejszającym się udziale sacharozy, dostarczały zapylaczom coraz większe ilości cukrów łatwiej przyswajalnych – glukozy i fruktozy. Okazało się również możliwe stwierdzenie, które gatunki zapylaczy preferują nektar o różnym stosunku masy sacharozy do sumy mas heksoz, np. [38]:
- > 0,5 – duże pszczoły, kolibry, motyle,
- < 0,5 – małe pszczoły, ptaki wróblowate, nietoperze neotropikalne.
Badając zawartości innych grup związków chemicznych w nektarach różnych okrytonasiennych stwierdzono m.in. że[39]:
- zwykle nie zawierają białka (śladowe ilości stwierdzono w 14% próbek),
- zawierają małe ilości aminokwasów, lecz wystarczające dla zaspokojenia zapotrzebowania motyli na azot,
- 49 gatunków w pięciu rodzinach roślin zapylanych przez pszczoły zawiera lipidy.
Niektóre nektary zawierają toksyny, prawdopodobnie pochodzące z innych części roślin. Toksyczność nektaru i pyłku dla pszczół jest niekiedy związana z obecnością mannozy, której pszczoły nie metabolizują. Zatrucia pszczół mogą również powodować zawarte w nektarze alkaloidy pirolizynowe (mogą one znaleźć się w miodzie, spożywanym przez ludzi). Niektóre motyle Ameryki Południowej wykorzystują te alkaloidy do wytwarzania feromonów[39].
Badania wpływu chemicznego składu nektaru na jego atrakcyjność dla owadów są prowadzone również w sztucznych warunkach laboratoryjnych. Jednym z tematów takich badań jest wpływ stężenia kofeiny – jednego z alkaloidów purynowych – na atrakcyjność roztworów cukru dla pszczół[40][41].
Kofeina wpływa na działanie układu nerwowego dzięki zmianom przepuszczalności jonów wapnia przez błony komórkowe (pod jej wpływem pająki przędą pajęczyny znacznie odbiegające od normy). Jest w przyrodzie wytwarzana m.in. w tkankach kawowca – częściowo chroni jego liście i nasiona przed zgryzaniem. Alkaloid ten występuje również w nektarze kawowca i niektórych cytrusów. W wyniku badań laboratoryjnych stwierdzono, że pszczoły trzykrotnie częściej odwiedzają roztwory fruktozy po dodaniu do nich niewielkiej ilości kofeiny (ich reakcje na wyższe stężenia alkaloidu są odwrotne). W warunkach naturalnych rośliny wytwarzające nektar o niewielkiej zawartości kofeiny są szybciej zapylane[40][41]. Przypomina to zjawiska uzależnień człowieka od używek i innych substancji psychotropowych poprawiających nastrój (zdefiniowanie pojęć nastrój, przyjemność, euforia jest trudne nawet w odniesieniu do psychiki człowieka, wiadomo jednak, że takie nastroje leżą u podstaw uzależnień)[c][42]. Metabolity wtórne, w tym alkaloidy i fenole, a także białka obecne w nektarze służą również ochronie przez organizmami niemutualistycznymi, zwierzętami i mikroorganizmami korzystającymi z wydzieliny bez korzyści dla rośliny[43].
Pyłek
Okrytonasienne wytwarzają pyłek – nośnik gametofitów męskich – w dużym nadmiarze w stosunku do potrzeb zapylania. Zawiera on duże ilości substancji odżywczych, np. 16–30% białka, 1–7% skrobi, 0–15% wolnych cukrów, 3–10% tłuszczy i inne składniki, m.in. witaminy, sole mineralne, karotenoidy i flawonoidy (w małych ilościach). Zapach pyłku bywa inny, niż zapach kwiatów – w przypadku Rosa rugosa i Rosa canina różnice dotyczą 31 terpenoidów alifatycznych i aromatycznych. Pyłek jest zwykle łatwo dostępny dla zapylaczy, głównie pszczół, które muszą go żuć (jego komórki mają twarde ścianki); jest też zbierany i rozprowadzany przez liczne inne zwierzęta. Część owadów (np. motyle) spożywa pyłek zmieszany z nektarem[44].
Nie są dotychczas jednoznacznie wyjaśnione powody obserwowanych różnic między zapachem kwiatów i pyłku oraz przyczyny produkowania pyłku w ilościach tak bardzo przekraczających potrzeby zapylania, że często poza zapylaczami korzystają z niego „współbiesiadnicy” (komensalizm)[44].
Uwagi
- ↑ W nawiasach – długość fali odpowiadająca maksimum pasma absorpcji w widmie.
- ↑ Związki chemiczne, które odgrywają równocześnie role feromonów płci owadów i atraktantów kwiatów (lub związki o podobnej budowie i zapachu), są wykorzystywane również przez ssaki (np. cyweton, muskon).
- ↑ Działanie niektórych preparatów farmakologicznych, stosowanych w leczeniu alkoholizmu, polega na ograniczaniu zdolności odczuwania oczekiwanej przyjemności.
Przypisy
- ↑ Hu S, Dilcher DL, Jarzen DM, Winship Taylor D. Early steps of angiosperm pollinator coevolution. „Proc Natl Acad Sci U S A”. 105 (1), s. 240–245, 2008. DOI: 10.1073/pnas.0707989105. PMID: 18172206 (ang.).
- ↑ a b c Stanley 2002 ↓, s. 559–561.
- ↑ a b International Chronostratigraphic Chart (ang.). W: International Commission on Stratigraphy [on-line]. stratigraphy.org. [dostęp 2014-05-31].
- ↑ a b „Przegląd Geologiczny”. 55 (9), 2007. Państwowy Instytut Geologiczny (pol.).
- ↑ C.M. Rice, W.A. Ashcroft, D.J. Batten i współ. A Devonian auriferous hot spring system, Rhynie, Scotland. „Journal of the Geological Society, London”. 152 (2), s. 229–250, 1995. DOI: 10.1144/gsjgs.152.2.0229 (ang.).
- ↑ Dzik 2003 ↓, s. 370–382.
- ↑ Dzik 2003 ↓, s. 395–402.
- ↑ Weiner 2003 ↓, s. 387–389.
- ↑ Sedgwick Museum of Earth Sciences, University of Cambridge (ang.). W: Strona internetowa muzeum [on-line]. www.sedgwickmuseum.org. [dostęp 2014-05-29].
- ↑ Harborne 1997 ↓, s. 56.
- ↑ Weiner 2003 ↓, s. 389.
- ↑ Krebs 1997 ↓, s. 25.
- ↑ Harborne 1997 ↓, s. 57.
- ↑ a b Harborne 1997 ↓, s. 90.
- ↑ Stanisław Bursa: Chemia fizyczna. Wyd. Wyd. 2 popr. Warszawa: Wydawnictwo Naukowe PWN, 1979, s. 152–154. ISBN 83-01-00152-6.
- ↑ Zausznica 1959 ↓, s. 114–135.
- ↑ Zausznica 1959 ↓, s. 272–276.
- ↑ Harborne 1997 ↓, s. 59.
- ↑ Harborne 1997 ↓, s. 62–63.
- ↑ a b Harborne 1997 ↓, s. 60–61.
- ↑ Harborne 1997 ↓, s. 66–67.
- ↑ a b Harborne 1997 ↓, s. 67–68.
- ↑ Harborne 1997 ↓, s. 58.
- ↑ Harborne 1997 ↓, s. 71.
- ↑ Harborne 1997 ↓, s. 71–74.
- ↑ Harborne 1997 ↓, s. 55–57, 74–82.
- ↑ L. Birnbaumer. G Proteins in Signal Transduction. „Annual Review of Pharmacology and Toxicology”. 30, s. 675–705, April 1990. DOI: 10.1146/annurev.pa.30.040190.003331 (ang.).
- ↑ William F Ganong: Fizjologia. Warszawa: Wydawnictwo Lekarskie PZWL, 2009. ISBN 978-83-200-3989-4.
- ↑ Olgierd Narkiewicz, Janusz Moryś: Neuroanatomia czynnościowa i kliniczna. Warszawa: Wydawnictwo Lekarskie PZWL, 2003. ISBN 978-83-200-3751-7.
- ↑ Aphid Olfaction: unpublished Electroantennogram Studies from 1993–1996 by J.H. Visser & P.G.M. Piron (ang.). www.olfacts.nl. [dostęp 2016-07-31]. [zarchiwizowane z tego adresu (2014-04-20)].
- ↑ Prodpran Thakeow, Stefan Schütz: Insect Antennae as Promising Biosensors for Wood-rotting Fungi. [dostęp 2016-07-31]. [zarchiwizowane z tego adresu (2007-10-23)].
- ↑ Siemion 1985 ↓, s. 336–344.
- ↑ Harborne 1997 ↓, s. 74–82.
- ↑ a b Romuald Klimek: Olejki eteryczne. Warszawa: Wydawnictwo Przemysłu Lekkiego i Spożywczego, 1957, s. 359–365.
- ↑ a b c d Harborne 1997 ↓, s. 76–78.
- ↑ Harborne 1997 ↓, s. 79–82.
- ↑ Harborne 1997 ↓, s. 82.
- ↑ a b Harborne 1997 ↓, s. 83–84.
- ↑ a b Harborne 1997 ↓, s. 84–88.
- ↑ a b L. Chittka, F. Peng. Neuroscience. Caffeine boosts bees’ memories. „Science; 339(6124):1157-9.”, 8 marca 2013. DOI: 10.1126/science.1234411. PMID: 23471393 (ang.).
- ↑ a b G.A. Wright, D.D. Baker, M.J. Palmer i wsp. Caffeine in floral nectar enhances a pollinator’s memory of reward. „Science; 339(6124):1202-4.”, 8 marca 2013. DOI: 10.1126/science.1228806. PMID: 23471406 (ang.).
- ↑ Jerzy Vetulani: Alkoholizm i jego leczenie farmakologiczne (pol.). W: Piękno neurobiologii Blog Jerzego Vetulaniego [on-line]. vetulani.wordpress.com. [dostęp 2014-06-02].
- ↑ González-Teuber M, Heil M. Nectar chemistry is tailored for both attraction of mutualists and protection from exploiters. „Plant Signal Behav”. 4 (9), s. 809–813, 2009. PMID: 19847105 (ang.).
- ↑ a b Harborne 1997 ↓, s. 88–89.
Bibliografia
- Antonina Rumińska: Rośliny lecznicze. Podstawy biologii i agrotechniki. Warszawa: Państwowe Wydawnictwo Naukowe, 1973.
- J.B. Harborne: Ekologia biochemiczna. Warszawa: Wydawnictwo Naukowe PWN, 1997. ISBN 83-01-12242-0.
- Jerzy Dzik: Dzieje życia na Ziemi. Warszawa: Wydawnictwo Naukowe PWN, 2003. ISBN 83-01-14038-0.
- January Weiner: Życie i ewolucja biosfery. Warszawa: Wydawnictwo Naukowe PWN, 2003. ISBN 83-01-14047-X.
- Charles J. Krebs: Ekologia. Eksperymentalna analiza rozmieszczenia i liczebności. Warszawa: Wydawnictwo Naukowe PWN, 1997. ISBN 83-01-14047-X.
- Ignacy Z. Siemion: Biostereochemia. Warszawa: Wydawnictwo Naukowe PWN, 1985. ISBN 83-01-14047-X.
- Steven M. Stanley: Historia Ziemi. Warszawa: Wydawnictwo Naukowe PWN, 2002. ISBN 83-01-13425-1.
- Alicja Szweykowska, Jerzy Szweykowski: Botanika Systematyka. Wyd. t. 2, wydanie 10. Warszawa: Wydawnictwo Naukowe PWN, 2007. ISBN 83-01-10951-3.
- Adam Zausznica: Nauka o barwie. Warszawa: Wydawnictwo Naukowe PWN, 1959.
Linki zewnętrzne
- A.S. Leonard, J. Brent, D.R. Papaj, A. Dornhaus. Floral nectar guide patterns discourage nectar robbing by bumble bees. „PLoS One;8(2):e55914.”, 2013 Feb 13. DOI: 10.1371/journal.pone.0055914. PMID: 23418475 (ang.).
- A. Köhler, C.W. Pirk, S.W. Nicolson. Honeybees and nectar nicotine: deterrence and reduced survival versus potential health benefits. „J Insect Physiol.;58(2):286-92.”, 2011 Dec 13. DOI: 10.1016/j.jinsphys.2011.12.002. PMID: 22185936 (ang.).
- Piotr Panek: Kawa z cukrem, prosto do ula (pol.). W: NIEDOWIARY, Blog szalonych naukowców [on-line]. naukowy.blog.polityka.pl, 14 września 2013. [dostęp 2014-06-02].
- Partnerstwo roślin i owadów (pol.). W: Bądź na pTAK, Ogólnopolska Społeczna Kampania Wiedzy i Edukacji Przyrodniczej [on-line]. www.jestemnaptak.pl, 23 czerwca 2013. [dostęp 2016-12-03].
Media użyte na tej stronie
chemical strukture of raffinose
Struktura alfa-D-glukozy (projekcja Hawortha)
luteolinidin
Autor: Beatriz Moisset, Licencja: CC BY-SA 2.5
Andrena bee, female. Columbia county, New York state. https://bugguide.net/node/view/43557
Chemical structure of borneol
Skeletal model of bornyl acetate. ... I didn't like making this one
Autor: Joanna Kośmider, Licencja: CC BY-SA 3.0
Pomiar napięcia w węchowym czujniku owadów (elektroantenografia)
chemical structure of melezitose
Autor: Dr. Günter Bechly, Licencja: CC BY-SA 3.0
Stenophlebia latreillei (Odonata: Stenophlebiidae), Upper Jurassic, Solnhofen Plattenkalk, specimen 0004 in private collection Günther Koschny (Bad Soden, Germany)
Trehalose; α-D-Glucopyranosid-α-D-glucopyranosid
Chemical Structure of Porphin.
Geraniol (Bestandteil ätherischer Öle)
Autor: Dave Kennard, Licencja: CC BY-SA 3.0
Spectral comparison of a Wild Strawberry (Fragaria vesca) flower in reflected visible light (top), ultraviolet light (middle) and infrared light (bottom).
The flower has a clear UV nectar guide pattern, with the petals appearing darker at the base in ultraviolet. The centre of the flower also appears much darker in ultraviolet.
In infrared the centre of the flower appears much brighter than it does under visible light.Autor: Verisimilus, Licencja: CC BY 3.0
Crossotheca hughesiana.. From the Sedgwick Museum's collection.
Autor: Marcus Yeagley, Licencja: CC BY-SA 2.0
One of my girlfriend's pet frogs in her tank. I think that is Rika (a particularly stupid frog)>
Autor: Brocken Inaglory, Licencja: CC-BY-SA-3.0
A hummingbird and his flowers. The image was taken in w:San Francisco
Artistic depiction of early Devonian land-flora.
Illustration of Catasetum macrocarpum (as syn. Catasetum tridentatum )
Second page of Charles Darwin's article on Catasetum pollination in Journal of the proceedings of the Linnean society, vol. 6 page 151 - 157
Structure of Maltose