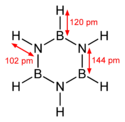Borazol
| |||||||||||||||||||||
 | |||||||||||||||||||||
| |||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||
| Wzór sumaryczny | B3N3H6 | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 80,50 g/mol | ||||||||||||||||||||
| Wygląd | bezbarwna ciecz[3] | ||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||
| PubChem | |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||
Borazol, borazyna, B
3N
3H
6 – nieorganiczny związek chemiczny, związek aromatyczny boru, azotu i wodoru o właściwościach fizycznych zbliżonych do benzenu.
Właściwości
Jest to bezbarwna, palna ciecz o charakterystycznym zapachu, będąca dobrym rozpuszczalnikiem wielu substancji. Borazyna ulega reakcjom charakterystycznym dla związków aromatycznych (np. substytucji elektrofilowej), jest znacznie bardziej reaktywna od benzenu, co przypisać można jedynie częściowemu charakterowi aromatycznemu cząsteczki. W wodzie rozkłada się na kwas borowy, amoniak i wodór.
Otrzymywanie
Otrzymywanie poprzez ogrzewanie diboranu w strumieniu amoniaku w temperaturze 250–300 °C:
- 3B
2H
6 + 6NH
3 → 2B
3H
6N
3 + 12H
2
Struktura
Borazyna jest izostrukturalna z benzenem, z kątami między wiązaniami ok. 120° i zbliżonymi długościami wiązań (B−N: 0,1436 nm, C−C: 0,1397 nm). Długość wiązania B–N w borazynie jest pośrednia pomiędzy wiązaniem pojedynczym B−N (0,151 nm) a podwójnym B=N (0,131 nm). Atomy azotu mają cząstkowy ładunek dodatni, a boru – ujemny. Spowodowane jest to delokalizacją elektronów z wolnych par elektronowych atomów azotu, co opisują struktury mezomeryczne cząsteczki. Delokalizacja ta wynika z elektronodonorowych własności azotu (zasada Lewisa, elektroujemność 3,04) oraz elektronoakceptorowych własności boru (kwas Lewisa, elektroujemność 2,04). Efektem delokalizacji elektronów jest spłaszczenie cząsteczki i częściowe właściwości aromatyczne.
Zastosowanie
Borazyna zwana jest „nieorganicznym benzenem”. Stosowana jako rozpuszczalnik substancji organicznych, a także wykorzystywany do wytwarzania warstw azotku boru (BN).
Przypisy
- ↑ a b Neil G. Connelly i inni, Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005 (Red Book), International Union of Pure and Applied Chemistry, RSC Publishing, 2005, s. 97, ISBN 978-0-85404-438-2 (ang.).
- ↑ Borazine, [w:] PubChem [online], United States National Library of Medicine, CID: 6327614 (ang.).
- ↑ a b c d e CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 95, Boca Raton: CRC Press, 2014, s. 4-53, ISBN 978-1-4822-0867-2 (ang.).
Media użyte na tej stronie
Space-filling model of the borazine molecule
Electrical potential surface of the borazine molecule, created with Spartan ST
Structure and dimensions of borazine