Bruzdnice
| Ten artykuł od 2012-09 zawiera treści, przy których brakuje odnośników do źródeł. |
 Bruzdnice widziane przez mikroskop | |||
| Systematyka[1] | |||
| Domena | |||
|---|---|---|---|
| Supergrupa | |||
| Królestwo | |||
| Infrakrólestwo | Halvaria | ||
| Gromada | Miozoa | ||
| Podgromada | |||
| Nadklasa | Dinoflagellata | ||
| Klasa | Dinophyceae | ||
| Nazwa systematyczna | |||
| Dinoflagellata | |||
| Synonimy | |||
| |||
Bruzdnice (Dinoflagellata) – takson glonów zaliczanych niegdyś do gromady tobołków, jedna z grup Protista. Większość bruzdnic to organizmy jednokomórkowe, choć czasami można spotkać je w postaci kolonii. Bruzdnice często posiadają pancerzyk składający się z płytek celulozowych oraz dwie wici. Stąd w dziewiętnasto- i dwudziestowiecznych systemach zaliczane były do wiciowców. Duża część organizmów należących do klasy Dinoflagellata to endosymbionty koralowców, małży, meduz. Bruzdnice endosymbiotyczne pozbawione są płytek celulozowych i wici. Takie bruzdnice zwane są zooksantelami (Zooxanthellae). Poprzez proces fotosyntezy dostarczają one swojemu gospodarzowi niezbędnych związków organicznych. Te bruzdnice, które nie posiadają zdolności fotosyntezy, najczęściej pasożytują na swoim gospodarzu.
Większość bruzdnic rozmnaża się bezpłciowo. U nielicznych grup Dinoflagellata stwierdzono rozmnażanie płciowe. Chromosomy u bruzdnic są trwale skondensowane, nawet wtedy, gdy nie następuje mitoza lub mejoza. W istocie procesy mitozy, jak i mejozy u tych protistów, są również nietypowe, np. nie zanika błona jądrowa. Zaliczane są do supergrupy Chromalveolata[2].
Bruzdnice są ważnymi producentami w ekosystemach morskich. Od czasu do czasu przechodzą eksplozje populacyjne, które są przyczyną czerwonych przypływów (zakwitów). Podczas takich zakwitów, niektóre bruzdnice produkują toksyny, będące przyczyną masowego wymierania ryb. Toksyny te są nieszkodliwe dla ostryg, czy chociażby omułków, żywiących się tymi organizmami. U ludzi, którzy spożyli takie ostrygi, może występować paralityczne zatrucie skorupiakowe, objawiające się niewydolnością układu oddechowego.
Historia
W 1753 roku pierwsze bruzdnice zostały opisane przez Henry'ego Bakera jako „żyjątka, które tworzą w wodzie morskiej iskrzące światło[3]” i nazwane przez Otto Friedricha Müllera w 1773 roku[4]. Termin ten wywodzi się z greckiego słowa δῖνος (dinos), oznaczającego „wirowanie”, i łac. flagellum, zdr. od „bicz”.
W latach trzydziestych XIX wieku niemiecki mikroskopista Christian Gottfried Ehrenberg zbadał wiele próbek wody i planktonu i wyodrębnił kilka rodzajów bruzdnic, których nazwy są nadal stosowane, w tym Peridinium, Prorocentrum i Dinophysis[5].
Te same bruzdnice zostały po raz pierwszy włączone przez Otto Bütschliego w 1885 r. do rzędu wiciowców o nazwie Dinoflagellida[6]. Botanicy traktowali je jako glony o nazwie Pyrrophyta lub Pyrrhophyta („glony ogniste”; gr. pyrr(h)os, ogień, w nawiązaniu do występującej u niektórych gatunków bioluminescencji) lub Dinophyta.
Morfologia
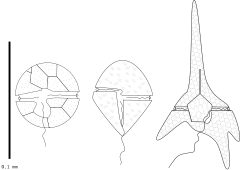
Bruzdnice są jednokomórkowe i posiadają dwie odmienne wici wychodzące ze strony brzusznej. Jedna wić jest poprzeczna, wstęgowata, a druga podłużna gładka, skierowana ku tyłowi komórki[7][8][9]. Określenia stron brzuszna-grzbietowa, lewa-prawa, typowe dla morfologii zwierzęcej, pochodzą z czasów, gdy bruzdnice uważano za jednokomórkowe zwierzęta[10]. Poprzeczna witka to falista wstążka, w której zewnętrzna krawędź faluje od podstawy do końcówki. Na krawędzi mogą występować proste włoski, które mogą mieć różną długość. Ruch wiciowy napędza komórkę i pozwala jej się obracać.. Podłużna wić ma konwencjonalny wygląd, z niewielką ilością włosów lub bez włosów. Wici znajdują się w powierzchniowych zagłębieniach.
Bruzdnice mają złożone pokrycie komórek zwane amfiesmą, złożone z szeregu błon, spłaszczonych pęcherzyków i struktur pokrewnych[11][12]. U niektórych bruzdnic pęcherzyki te zawierają celulozową płytkę (tarczkę)[10]. Tarczki mogą zawierać również dodatek krzemionki lub kalcytu[13]. Sąsiadujące tarczki łączą się szwami, w związku tym, u niektórych bruzdnic wykształcony jest pancerzyk (theca). U części bruzdnic jest on delikatny, a tarczki są liczne, z reguły sześciokątne i nie tworzą regularnego układu, choć da się wyróżnić bruzdy i główne strony pancerzyka. Taki typ określa się jako gymnodinioidaln[10].
Chloroplasty u większości fotosyntetycznych bruzdnic posiadają trzy błony, co oznacza, że prawdopodobnie powstały one na drodze endosymbiozy glonów. Większość gatunków fotosyntetycznych zawiera chlorofile a i c2, karotenoid, beta-karoten oraz grupę ksantofili. Pigmenty te nadają wielu wiciowcom charakterystyczny złoty kolor. Komórka bruzdnicy posiada również typowe organelle eukariotyczne, takich jak aparat Golgiego, mitochondria, ziarna lipidów i skrobi. Niektóre z nich posiadają plamkę oczną, tj. wrażliwą na światło organellę[14].
Klasyfikacja
Wiciowce są protistami, które zostały sklasyfikowane przez Międzynarodowy Kodeksu Nomenklatury Botanicznej oraz Międzynarodowy Kodeks Nomenklatury Zoologicznej.
Chociaż klasyfikowane jako eukarionty, jądra bruzdnic nie są charakterystycznie eukariotyczne, ponieważ niektóre z nich nie mają histonów i nukleosomów oraz utrzymują stale skondensowane chromosomy podczas mitozy. Jądro bruzdnicy zostało nazwane „mezokariotycznym” przez Dodge'a (1966)[15], ze względu na posiadanie cech pośrednich między zwiniętymi obszarami DNA prokariotycznych bakterii a dobrze zdefiniowanym jądrem eukariotycznym[16].
Jakob Schiller (1931–1937) przedstawił opis wszystkich znanych gatunków, zarówno morskich, jak i słodkowodnych[17]. Później Alain Sournia (1973[18], 1978[19], 1982[20], 1990[21], 1993) skatalogował nowe wpisy taksonomiczne opublikowane po Schillerze. Sournia (1986) podał opisy i ilustracje rodzajów morskich wiciowców[22]. Najnowszy indeks napisał Gómez[23].
Ekologia
Środowisko
Bruzdnice mogą występować we wszystkich środowiskach wodnych: słonych i słodkich, w tym w śniegu lub lodzie. Są one również powszechne w środowisku bentonicznym i lodzie morskim.
Odżywianie
Bruzdnice stosują trzy sposoby odżywiania: fototrofię, miksotrofię i heterotrofię. Około połowa żywych gatunków bruzdnic to autotrofy posiadające chloroplasty. Fototrofami mogą być fotoautotrofy lub auksotrofy. Mieszanki dinotroficzne są fotosyntetycznie aktywne, ale są również heterotroficzne. Mikrofotrofy fakultatywne, w których autotrofia lub heterotrofia są wystarczające do odżywiania, są klasyfikowane jako amfitroficzne. Niektóre wolno żyjące bruzdnice nie mają chloroplastów, ale są gospodarzami fototroficznych endosymbiontów. Kilka z nich może wykorzystywać obce chloroplasty (kleptochloroplasty), otrzymywane z pożywienia (kleptoplastyka). Niektóre wiciowce mogą żywić się innymi organizmami jako drapieżniki lub pasożyty[24].
Prawie połowa wszystkich znanych gatunków ma chloroplasty, które są oryginalnymi plastydami perydyninowymi lub nowymi plastydami pozyskanymi z innych linii jednokomórkowych glonów poprzez endosymbiozę. Pozostałe gatunki utraciły swoje zdolności fotosyntetyczne i przystosowały się do heterotroficznego, pasożytniczego lub kleptoplastycznego stylu życia[25][26].
Sposoby wychwytu i spożycia w wiciowcach są dość zróżnicowane. Kilka bruzdnic (np. Ceratium hirundinella[27], Peridinium globulus[28]) przyciąga zdobycz przez prądy wodne utworzone przez wici do regionu bruzdowatego komórki. U niektórych bruzdnic duża zasłona do karmienia jest wyciągana w celu chwytania zdobyczy, która jest następnie trawiona pozakomórkowo[29]. Oblea, Zygabikodinium i Diplopsalis są jedynymi innymi rodzajami Dinoflagellata, o których wiadomo, że używają tego konkretnego mechanizmu karmienia[30]. Grzybica katodinium (Gymnodinium), powszechnie spotykana jako zanieczyszczenie w kulturach glonów lub rzęs, karmi się przywiązaniem do swojej ofiary i przyjmowaniem cytoplazmy zdobyczy przez rozciągliwą szypułkę[31].
Bioluminescencja
W nocy woda może nabrać „iskrzącego” wyglądu dzięki bioluminescencji bruzdnic. Ponad 18 rodzajów jest bioluminescencyjnych, z czego większość z nich emituje niebiesko-zielone światło[32]. Gatunki te zawierają scyntylony, pojedyncze ciała cytoplazmatyczne (o średnicy około 0,5 µm) rozmieszczone głównie w obszarze korowym komórki, w kieszeniach głównej wakuoli komórki. Zawierają lucyferazę dinoflagellatową, główny enzym biorący udział w bioluminescencji bruzdnicy, oraz lucyferynę, pierścień tetrapirolowy pochodzący z chlorofilu, który działa jako substrat dla reakcji wytwarzającej światło. Luminescencja występuje jako krótki (0,1 s) niebieski błysk (maks. 476 nm), gdy organizm jest stymulowany, zwykle przez zaburzenia mechaniczne. Dlatego też, gdy woda zawierająca bruzdnice jest wzburzana, na przykład ruchem łodzi, pływaniem lub falami – można zaobserwować pod powierzchnią niebieskie iskrzące się światło[33].
Bioluminescencja bruzdnicy jest kontrolowana przez zegar dobowy i występuje tylko w nocy. Szczepy luminescencyjne i nieluminescencyjne mogą występować u tego samego gatunku. Liczba scyntylonów jest wyższa w nocy niż w dzień i załamuje się pod koniec nocy, w czasie maksymalnej bioluminescencji[34].
Bioluminescencyjne zatoki ekosystemu bruzdnic należą do najrzadszych i najbardziej wrażliwych[35], a najsłynniejsze z nich to Zatoka Bioluminescencyjna w La Parguera, Lajas, Puerto Rico; Zatoka Mosquito w Vieques. Laguna bioluminescencyjna znajduje się również w pobliżu Montego Bay na Jamajce, a bioluminescencyjne porty otaczają Castine w stanie Maine. W Stanach Zjednoczonych Centralna Floryda mieści laguny Indian River Lagoon, które latem obfitują w bruzdownice, a zimą w bioluminescencyjny ctenofor[36]. Na świecie zidentyfikowano pięć zatok bioluminescencyjnych, a trzy z nich znajdują się na Portoryko.
Przypisy
- ↑ Taxonomy Browser Superclass: Dinoflagellata, AlgaeBase [dostęp 2022-02-19].
- ↑ Simpson, Alastair G.B.; Roger, Andrew J. The real ‘kingdoms’ of eukaryotes. „Current Biology”. 14, s. R693-R696, 2004. ISSN 0960-9822. PMID: 15341755.
- ↑ Henry Baker, Employment for the microscope, London: Printed for R. Dodsley, 1753, s. 403–406, DOI: 10.5962/bhl.title.51442 [dostęp 2019-06-18].
- ↑ Otto Frederich Müller, Vermium terrestrium et fluviatilium, seu Animalium Infusoriorum, Helmithicorum et Testaceorum, non marinorum, succincta historia, Havniæ: apud Heineck et Faber, 1773, s. 34, 135, DOI: 10.5962/bhl.title.12733 [dostęp 2019-06-18].
- ↑ Christian Gottfried Ehrenberg, Beiträge zur Kenntniss der Organisation der Infusorien und ihrer geographischen Verbreitung, besonders in Sibirien, „Abhandlungen der Königlichen Akademie der Wissenschaften zu Berlin”, Berlin: Realschul-Buchhandlung, 1830, DOI: 10.5962/bhl.title.143632 [dostęp 2019-06-18].
- ↑ Unterabtheilung (Ordnung) Dinoflagellata, [w:] Heinrich Georg Bronn, C.K. Hoffmann, Dr. H. G. Bronn's Klassen und Ordnungen des Thier-Reichs, Leipzig: C.F. Winter, 1892, s. 906–1029, DOI: 10.5962/bhl.title.53417 [dostęp 2019-06-18].
- ↑ Frank John Rupert Taylor, Non-helical transverse flagella in dinoflagellates, „Phycologia”, 14 (1), 1975, s. 45–47, DOI: 10.2216/i0031-8884-14-1-45.1, ISSN 0031-8884 [dostęp 2019-06-18].
- ↑ Paul H. Leblond, Frank John Rupert Taylor, The propulsive mechanism of the dinoflagellate transveese flagellum reconsidered, „Biosystems”, 8 (1), 1976, s. 33–39, DOI: 10.1016/0303-2647(76)90005-8, ISSN 0303-2647 [dostęp 2019-06-18].
- ↑ Gregory Gaines, Frank John Rupert Taylor, Form and Function of the Dinoflagellate Transverse Flagellum1, „The Journal of Protozoology”, 32 (2), 1985, s. 290–296, DOI: 10.1111/j.1550-7408.1985.tb03053.x, ISSN 1550-7408 [dostęp 2019-06-18] (ang.).
- ↑ a b c F.J.R. Max Taylor, Charles Atwood Kofoid and his Dinoflagellate Tabulation System: an Appraisal and Evaluation of the Phylogenetic Value of Tabulation, „Protist”, 150 (2), 1999, s. 213–220, DOI: 10.1016/S1434-4610(99)70023-4 [dostęp 2022-02-16] (ang.).
- ↑ Lenita C. Morrill, Alfred R. Loeblich, Ultrastructure of the Dinoflagellate Amphiesma, G.H. Bourne, J.F. Danielli, K.W. Jeon (red.), t. 82, Academic Press, 1983, s. 151–180, DOI: 10.1016/s0074-7696(08)60825-6 [dostęp 2019-06-18].
- ↑ Harald Netzel, Georg Dürr, Dinoflagellate cell cortex, [w:] David L. Spector, Dinoflagellates, Orlando: Academic Press, 1984, ISBN 978-0-323-13813-0, OCLC 681524682 [dostęp 2019-06-19].
- ↑ Przemysław Gedl, Cysty Dinoflagellata - zarys biologii i morfologii oraz ocena przydatności w biostratygrafii i paleoekologii, „Przegląd Geologiczny”, 43 (3), 1995, s. 203-210.
- ↑ Jeremiah D. Hackett i inni, Dinoflagellates: a remarkable evolutionary experiment, „American Journal of Botany”, 91 (10), 2004, s. 1523–1534, DOI: 10.3732/ajb.91.10.1523 [dostęp 2019-06-19] (ang.).
- ↑ Karen A. Steidinger, Karl Jangen, Dinoflagellates, Elsevier, 1997, s. 387–584, DOI: 10.1016/b978-012693018-4/50005-7, ISBN 978-0-12-693018-4 [dostęp 2019-06-18].
- ↑ Karen A. Steidinger, Karl Jangen, Dinoflagellates, [w:] Carmelo R. Tomas, Grethe Rytter Hasle, Identifying marine phytoplankton, San Diego: Academic Press, 1997, ISBN 978-0-12-693018-4, OCLC 162128801 [dostęp 2019-06-19].
- ↑ Gustav Lindau, Hans Melchior, Klasse: Dinoflagellatae, Berlin, Heidelberg: Springer Berlin Heidelberg, 1926, s. 172–181, DOI: 10.1007/978-3-642-99255-1_12, ISBN 978-3-642-98441-9 [dostęp 2019-06-18].
- ↑ Alain Sournia, Catalogue des espèces et taxons infraspécifiques de Dinoflagellés marins actuels publiés depuis la révision de J. Schiller, I. Dinoflagellés libres, „Beihefte zur Nova Hedwigia”, 48, 1973, ISSN 0078-2238.
- ↑ Alain Sournia, Catalogue des espèces et taxons infraspécifiques de dinoflagellés marins actuels publiés depuis la révision de J. Schiller. III. (Complément), „Revue algologique”, 13 (1), Paryż: Muséum national d'histoire naturelle, 1978, s. 3–40, ISSN 0035-0702.
- ↑ Alain Sournia, Catalogue des espèces et taxons infraspécifiques de Dinoflagellés marins actuels publiés depuis la révision de J. SCHILLER IV. (Complément), „Archiv für Protistenkunde”, 126 (2), 1982, s. 151–168, DOI: 10.1016/S0003-9365(82)80046-8 [dostęp 2019-06-19] (ang.).
- ↑ Alain Sournia, Catalogue des espèces et taxons infraspécifiques de Dinoflagellés marins actuels publiés depuis la révision de J. Schiller. V (Complément), „Acta Protozoologica”, 29 (4), 1990, s. 321–346.
- ↑ Alain Sournia, Michel Ricard, Marie-Josèphe Chrétiennot-Dinet, Atlas du phytoplancton marin, t. 1, Paris: Editions du Centre national de la recherche scientifique, 1986, ISBN 2-222-03823-5, OCLC 15550593 [dostęp 2019-06-19].
- ↑ Fernando Gómez, Checklist of Mediterranean Free-living Dinoflagellates, „Botanica Marina”, 46 (3), 2005, s. 215–242, DOI: 10.1515/BOT.2003.021 [dostęp 2019-06-18].
- ↑ Eberhard Schnepf, Malte Elbrächter, Nutritional strategies in dinoflagellates: A review with emphasis on cell biological aspects, „European Journal of Protistology”, 28 (1), 1992, s. 3–24, DOI: 10.1016/S0932-4739(11)80315-9, ISSN 0932-4739 [dostęp 2019-06-18].
- ↑ Andrzej Bodył, Krzysztof Moszczyński, Did the peridinin plastid evolve through tertiary endosymbiosis? A hypothesis, „European Journal of Phycology”, 41 (4), 2006, s. 435–448, DOI: 10.1080/09670260600961080, ISSN 0967-0262 [dostęp 2019-06-18].
- ↑ Kjetill S. Jakobsen i inni, Genome Evolution of a Tertiary Dinoflagellate Plastid, „PLOS ONE”, 6 (4), 2011, e19132, DOI: 10.1371/journal.pone.0019132, ISSN 1932-6203 [dostęp 2019-06-18] (ang.).
- ↑ John D. Dodge, Richard M. Crawford, The Morphology and Fine Structure of Ceratium Hirundinella (dinophyceae)1, „Journal of Phycology”, 6 (2), 1970, s. 137–149, DOI: 10.1111/j.1529-8817.1970.tb02372.x, ISSN 1529-8817 [dostęp 2019-06-18] (ang.).
- ↑ Adam S. Bursa, The Annual Oceanographic Cycle at Igloolik in the Canadian Arctic: II. The Phytoplankton, „Journal of the Fisheries Research Board of Canada”, 18 (4), 1961, s. 563–615, DOI: 10.1139/f61-046, ISSN 0015-296X [dostęp 2019-06-18].
- ↑ F.J.R. Taylor, Gregory Gaines, Extracellular digestion in marine dinoflagellates, „Journal of Plankton Research”, 6 (6), 1984, s. 1057–1061, DOI: 10.1093/plankt/6.6.1057, ISSN 0142-7873 [dostęp 2019-06-18] (ang.).
- ↑ Lars-Johan Naustvoll, Growth and grazing by the thecate heterotrophic dinoflagellate Diplopsalis lenticula (Diplopsalidaceae, Dinophyceae), „Phycologia”, 37 (1), 1998, s. 1–9, DOI: 10.2216/i0031-8884-37-1-1.1, ISSN 0031-8884 [dostęp 2019-06-18].
- ↑ Howard J. Spero, Phagotrophy in Gymnodinium Fungiforme (pyrrhophyta): The Peduncle as an Organelle of Ingestion1, „Journal of Phycology”, 18 (3), 1982, s. 356–360, DOI: 10.1111/j.1529-8817.1982.tb03196.x, ISSN 1529-8817 [dostęp 2019-06-18] (ang.).
- ↑ Bioluminescence and circadian rhythms., Hoboken, NJ, USA: John Wiley & Sons, Inc., 28 stycznia 2005, s. 141–170, DOI: 10.1002/0471459186.ch6, ISBN 978-0-471-45918-7 [dostęp 2019-06-18].
- ↑ Steven H.D. Haddock, Mark A. Moline, James F. Case, Bioluminescence in the Sea, „Annual Review of Marine Science”, 2 (1), 2009, s. 443–493, DOI: 10.1146/annurev-marine-120308-081028, ISSN 1941-1405 [dostęp 2019-06-18].
- ↑ J.W. Hastings, D. Morse, L. Fritz, The circadian bioluminescence rhythm of Gonyaulax is related to daily variations in the number of light-emitting organelles, „Journal of Cell Science”, 95 (2), 1990, s. 321–328, ISSN 0021-9533, PMID: 2196272 [dostęp 2019-06-18] (ang.).
- ↑ Cheryl Lyn Dybas, Bright Microbes, „Scientific American”, 306 (5), 2012, s. 19–19, DOI: 10.1038/scientificamerican0512-19, ISSN 0036-8733 [dostęp 2019-06-19].
- ↑ Florida by Water: Experience Bioluminescence -- National Geographic, Travel, 10 lutego 2015 [dostęp 2019-06-18].
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
© Hans Hillewaert, CC BY-SA 4.0
Sea Sparkle at the Yacht Port of Zeebrugge, Belgium
Autor: Mike, Licencja: CC BY-SA 2.0
This is an image of a Carlsbad, CA beach during the 2005 red tide. The only image manipulation was the Photoshop Auto Levels command. The greenish-blue light is caused by millions (billions?) of microscopic organisms (Lingulodinium polyedrum) that bioluminesce when they are disturbed (as in a breaking wave). The effect is quite dramatic. The organisms also get washed to shore, so when you walk in the sand, your footsteps light up. If you are brave enough to enter the water at night, there will be a glow around you as you swim. Red Tides caused by L. polyedrum are not toxic.







