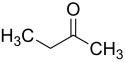
Butanon
| |||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C4H8O | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | CH | ||||||||||||||||||||||||||||||||||
| Masa molowa | 72,11 g/mol | ||||||||||||||||||||||||||||||||||
| Wygląd | |||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||||||||
| Legalność w Polsce | |||||||||||||||||||||||||||||||||||
Butanon – organiczny związek chemiczny z grupy ketonów. Jest bezbarwną, łatwopalną i lotną cieczą o ostrym, słodkim zapachu zbliżonym do acetonu. Bardzo dobrze rozpuszcza się w wodzie w warunkach normalnych, jednak słabiej w wyższej temperaturze. Jest przemysłowo wytwarzany na dużą skalę.
Występowanie
Butanon występuje w śladowych ilościach w powietrzu. Wydzielany jest wraz ze spalinami samochodowymi oraz może pochodzić z fotooksydacji znajdujących się w powietrzu zanieczyszczeń, takich jak butan i innych węglowodorów[10]. Niewielkie ilości butanonu przedostają się do wody wodociągowej z rur PCW[11].
Otrzymywanie
Jednym ze sposobów otrzymywania butanonu jest hydratacja butenu do sec-butanolu, który następnie jest dehydrogenowany do ketonu[12][13] w fazie gazowej w temp. zazwyczaj w zakresie 350–400 °C[12]. W ten sposób otrzymuje się przemysłowo blisko 90% butanonu[12]:
- n-buten + H
2O → CH
3CH(OH)CH
2CH
3- CH
3CH(OH)CH
2CH
3 → CH
3C(O)CH
2CH
3 + H
2 - CH
Pozostała ilość butanonu wytwarzanego przemysłowo pochodzi z bezpośredniego utleniania butenu. proces można prowadzić:
- w fazie ciekłej jako reakcję rodnikową, w której butanon jest produktem ubocznym podczas produkcji kwasu octowego[12]
- w fazie gazowej, w reakcji katalitycznej[12][14].
Można go także otrzymać przez utlenianie butanu[13] lub z 2-metyloacetylooctanu etylu[14].
Właściwości
- współczynnik załamania: 1,37880[4]
- ciepło parowania (25 °C): 114,38 cal/g[8]
- ciepło właściwe (25 °C): 0,5267 cal/(g·K)[8]
- ciepło topnienia: 27,97 cal/g[8]
- ciepło spalania: −8082,4 cal/g[8]
- objętość krytyczna: 267,0 cm³/mol[8]
- granice wybuchowości: 1,9–11,5% obj.[8]
Zastosowania
Butanon jest wykorzystywany jako rozpuszczalnik w wielu procesach związanych z syntetycznymi żywicami, skórami i gumami oraz z powłokami winylowymi, nitrocelulozowymi i akrylowymi. Znajduje zastosowanie w wytwarzaniu smarów, lakierów, klejów, farmaceutyków, środków czyszczących i preparatów do usuwania farb i lakierów. Obecny jest w niewielkich ilościach w niektórych kosmetykach i produktach spożywczych jako środek zapachowy i smakowy. W przemyśle stosuje się go także do rozwłókniania drewna liściastego i formulacji pestycydów[15].
Jest także prekursorem w otrzymywaniu nadtlenku etylometyloketonu, który wykorzystywany jest jako katalizator w niektórych reakcjach polimeryzacji, oraz diacetylu. Może być także katalizatorem w otrzymywaniu kwasu tereftalowego z p oraz w produkcji hydrazyny[15].
Zagrożenia
Butanon jest drażniący, jednak poważne skutki zdrowotne mogą pojawić się dopiero przy dużych dawkach lub stężeniach. Butanon może przedostać się do organizmu poprzez drogi oddechowe, skórę i przewód pokarmowy. Krótkotrwała inhalacja par może prowadzić do podrażnienia górnych dróg oddechowych, gardła i spojówek. Działanie butanonu na skórę i przewód pokarmowy może spowodować podrażnienia i oparzenia. Kontakt ciekłego butanonu z oczami może skutkować nieodwracalnymi uszkodzeniami. Skutkami zatrucia mogą być bóle i zawroty głowy, nudności, senność, problemy z koncentracją i utrata przytomności. W skrajnych przypadkach może dojść do spowolnienia akcji serca, drętwienia kończyn, rozszerzenia źrenic, ślinotoku i neuropatii toksycznych[8][15][16]. Istnieją bardzo ograniczone informacje dotyczące skutków długotrwałego narażenia ludzi na butanon, jednak w testach na zwierzętach zaobserwowano negatywny wpływ na układ nerwowy, wątrobę, nerki i układ oddechowy[10].
Butanon ma specyficzne działanie na białka i może zaburzać funkcjonowanie enzymów. Z tego też powodu do badania jego toksyczności mogą być wykorzystywane linie komórkowe nerwiaka płodowego, ze względu na ich dużą wrażliwość[15].
Nie istnieją żadne informacje dotyczące szkodliwego działania na rozwój i rozrodczość oraz rakotwórczości butanonu w stosunku do człowieka[10]. Negatywne skutki rozwojowe, w tym utrata masy i wady rozwojowe płodu, zostały jednak zaobserwowane w badaniach szczurów i myszy narażonych na butanon poprzez inhalację lub spożycie[10].
Butanon jest łatwopalny i lotny. Pary gromadzą się w dolnych partiach pomieszczeń oraz w zagłębieniach terenu i mogą tworzyć z powietrzem mieszaniny wybuchowe o szerokim zakresie stężeń[8].
Przypisy
- ↑ a b c d e f Butanone, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 13330 [dostęp 2010-10-06] (niem. • ang.).
- ↑ a b Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- ↑ a b c d Methyl ethyl ketone, [w:] PubChem [online], United States National Library of Medicine, CID: 6569 (ang.).
- ↑ a b c d David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, ISBN 978-1-4200-9084-0 (ang.).
- ↑ a b c Methyl ethyl ketone, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2012-05-20] (ang.).
- ↑ a b c d e 2-Butanon (nr 360473) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2020-02-10]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Farmakopea Polska VIII, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2008, s. 3491, ISBN 978-83-88157-53-0.
- ↑ a b c d e f g h i j k l m Butanon, Zarządzanie Zagrożeniami dla Zdrowia i Środowiska „MANHAZ” [zarchiwizowane z adresu 2009-05-26].
- ↑ butanone (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2015-03-28].
- ↑ a b c d Methyl Ethyl Ketone (2-Butanone), U.S. Environmental Protection Agency, styczeń 2000 [zarchiwizowane z adresu 2016-05-22] (ang.).
- ↑ John Harte i inni, Toxics A to Z: a guide to everyday pollution hazards, University of California Press, 1991, s. 344–345, ISBN 978-0-520-07224-4 (ang.).
- ↑ a b c d e Wilhelm Neier, Guenter Strehlke, 2-Butanone, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, s. 3–5, DOI: 10.1002/14356007.a04_475 (ang.).
- ↑ a b J.G. Speight, Chemical and process design handbook, McGraw-Hill Professional, 2002, 2.328, ISBN 978-0-07-137433-0 (ang.).
- ↑ a b The Merck Index, wyd. 13.Monografia nr 6097.
- ↑ a b c d OSHA Regulated Hazardous Substances: Health, Toxicity, Economic and Technological Data, U.S. Occupational Safety and Health Administration, t. 1, William Andrew, 1990, s. 247–252, ISBN 978-0-8155-1240-0.
- ↑ 2-Butanone, NIOSH Pocket Guide to Chemical Hazards [dostęp 2010-10-06] (ang.).
Linki zewnętrzne
- Butanone, [w:] Human Metabolome Database [online], Genome Canada, HMDB00474 [dostęp 2010-10-06] (ang.).
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Structure of butan-2-one