Chiralność cząsteczek


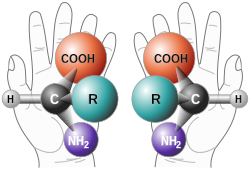
Chiralność (gr. χείρ/ cheir – ręka) – cecha cząsteczek chemicznych przejawiająca się w tym, że cząsteczka wyjściowa i jej odbicie lustrzane nie są identyczne i, podobnie jak wszystkie inne obiekty chiralne, nie można ich nałożyć na siebie na drodze translacji i obrotu w przestrzeni.
Cząsteczki chiralne występują w formie dwóch izomerów optycznych – enancjomerów. Oba enancjomery mają takie same właściwości chemiczne w środowisku achiralnym[1][2][3]. Związki te cechuje tzw. aktywność optyczna, zwaną również czynnością optyczną. Jest to zdolność do skręcania o pewien kąt płaszczyzny światła spolaryzowanego liniowo. Skręcalność światła przez związki chiralne polega na różnej szybkości rozchodzenia się w nich dwóch składowych polaryzacji liniowej (polaryzacji kołowej prawo lub lewoskrętnej). Innym przejawem aktywności optycznej jest tak zwany dichroizm kołowy, polegający na tym, że związki chiralne przy odpowiednio dobranej długości fali pochłaniają silniej jedną ze składowych kołowych, o ile w ogóle mają jakieś pasmo absorpcji w zakresie podczerwieni, światła widzialnego lub nadfioletu. Oba te zjawiska wiążą się z anizotropią współczynnika załamania w takich cząsteczkach. Równomolowa mieszanina dwóch enancjomerów jest nazywana racematem lub mieszaniną racemiczną[4].
Cząsteczka jest chiralna wtedy i tylko wtedy, gdy nie ma inwersyjnej osi symetrii (z czego wynika automatycznie, że nie może mieć także płaszczyzny symetrii ani środka symetrii). Chiralność nie jest tym samym, co asymetria (tj. brak nietrywialnych elementów symetrii) – obiekt chiralny może mieć np. dwukrotną oś symetrii.
Chiralność jest ważnym pojęciem w stereochemii i biochemii. Wiele związków występujących w organizmach jest chiralna i występuje w przyrodzie w postaci homochiralnej, to oznacza że w organizmach żywych zazwyczaj występuje tylko jeden z dwóch enancjomerów związku chiralnego, np. węglowodany, aminokwasy będące budulcem białek oraz kwasy nukleinowe[5]. Z tego powodu organizmy, które spożywają związek chiralny, zazwyczaj mogą metabolizować tylko jeden z jego enancjomerów. Z tego samego powodu dwa enancjomery środka farmaceutycznego mają zwykle różną siłę bądź sposób działania na organizm[6].
Rozróżnianie enancjomerów
Znane metody rozróżniania enancjomerów:
Zobacz też
Przypisy
- ↑ Władysław Gołkiewicz, Beata Polak, Chiral Separation of Amino Acid Enantiomers. Separation of Amino Acid Enantiomers on the Impregnated Plates with Chiral Reagent, [w:] Teresa Kowalska, Joseph Sherma (red.), Thin layer chromatography in chiral separations and analysis, CRC Press, 2019, s. 311, ISBN 978-0-367-45301-5, OCLC 1129822090.
- ↑ Umesh P. Aher i inni, Synthetic strategies toward 1,3-oxathiolane nucleoside analogues, „Beilstein Journal of Organic Chemistry”, 17, 2021, s. 2680–2715, DOI: 10.3762/bjoc.17.182, PMID: 34804240, PMCID: PMC8576827 [dostęp 2022-05-31] (ang.).
- ↑ Bernard Testa, Giulio Vistoli, Alessandro Pedretti, Organic Stereochemistry. Part 1. Symmetry Elements and Operations, Classification of Stereoisomers, „Helvetica Chimica Acta”, 96 (1), 2013, s. 4–30, DOI: 10.1002/hlca.201200469 [dostęp 2022-05-31] (ang.).
- ↑ racemate, [w:] A.D. McNaught, A. Wilkinson, Compendium of Chemical Terminology (Gold Book), S.J. Chalk (akt.), International Union of Pure and Applied Chemistry, wyd. 2, Oxford: Blackwell Scientific Publications, 1997, DOI: 10.1351/goldbook.R05025, ISBN 0-9678550-9-8 (ang.).
- ↑ Celia Blanco, Irene A. Chen, Connections Between Mathematical Models of Prebiotic Evolution and Homochirality, [w:] César Menor-Salván (red.), Prebiotic chemistry and chemical evolution of nucleic acids, t. 35, 2018, ISBN 978-3-319-93583-6 (ang.).
- ↑ Maria Elena Y. Cabusas, Importance of Chiral Separation, [w:] Chiral separations on HPLC derivatized polysaccharide CSPs: temperature, mobile phase and chiral recognition mechanism studies, rozprawa doktorska, Virginia Polytechnic Institute and State University, 1998, s. 1 [dostęp 2022-05-31] (ang.).
Linki zewnętrzne
- Alicja po drugiej stronie lustra – tekst na temat przyczyn chiralności biomolekuł.
Media użyte na tej stronie
이성질체
Amino Acid Chirality chirality with hands from http://www.nai.arc.nasa.gov/ A "chiral" molecule is one that is not superposable with its mirror image. Like left and right hands that have a thumb, fingers in the same order, but are mirror images and not the same, chiral molecules have the same things attached in the same order, but are mirror images and not the same. Although most amino acids can exist in both left and right handed forms, Life on Earth is made of left handed amino acids, almost exclusively. No one knows why this is the case. However, Drs. John Cronin and Sandra Pizzarello have shown that some of the amino acids that fall to earth from space are more left than right. Thus, the fact that we are made of L amino acids may be because of amino acids from space. Why do amino acids in space favor L? No one really knows, but it is known that radiation can also exist in left and right handed forms. So, there is a theory called the Bonner hypothesis, that proposes that left handed radiation in space (from a rotating neutron star for example) could lead to left handed amino acids in space, which would explain the left handed amino acids in meteorites. This is still speculative but our paper makes it much more plausible. In fact, this observations was one of the main reasons why we pursued this research. Although there were theories about how the amino acids could form in space in the ice, no one had shown that it was viable to make amino acids this way, until now.
Zwitterion-Alanine