Chlorek glinu
| |||||||||||||||||||||||||||||||||||||||||
 Próbki białego i żółtego AlCl 3·6H 2O ([Al(H 2O) 6]Cl 3) | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | AlCl3 | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 133,34 g/mol | ||||||||||||||||||||||||||||||||||||||||
| Wygląd | białe lub żółte ciało stałe | ||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||
| Inne aniony | trichlorek boru | ||||||||||||||||||||||||||||||||||||||||
| Inne kationy | fluorek glinu | ||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||||||||||||||||||
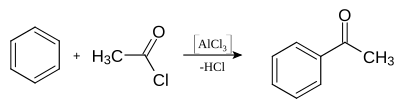
Chlorek glinu, AlCl3 – nieorganiczny związek chemiczny, sól kwasu solnego i glinu. Jest białym ciałem stałym[6] (produkty handlowe mogą mieć zabarwienie żółte[2]). Związek bezwodny dymi na powietrzu z powodu hydrolizy spowodowanej parą wodną. Jest kwasem Lewisa i stosowany jest głównie jako katalizator w reakcji Friedla-Craftsa[4].
Struktura
W stanie stałym chlorek glinu ma budowę krystaliczną o strukturze warstwowej, w której glin ma liczbę koordynacyjną 6[4]. W stanie ciekłym i gazowym (poniżej 400 °C) jest dimerem, Al2Cl6, zaś w wysokiej temperaturze przyjmuje formę monomeru, AlCl3 (forma wyłączna powyżej 800 °C)[3].
Heksahydrat ma charakter soli kompleksowej [Al(H
2O)
6]Cl
3[7].
Otrzymywanie
Bezwodny chlorek glinu otrzymuje się m.in. w reakcji glinu z chlorem lub chlorowodorem[8]:
- 2Al + 3Cl
2 → 2AlCl
3 (podstawowa metoda przemysłowa)[3]- 2Al + 6HCl → 2AlCl
3 + 3H
2 - 2Al + 6HCl → 2AlCl
Inną metodą przemysłową jest chlorowanie tlenku glinu mieszaniną chloru i tlenku węgla[3].
Heksahydrat można uzyskać rozpuszczając tlenek glinu w kwasie solnym, a w formie krystalicznej – przepuszczając HCl przez nasycony roztwór związku[3].
Właściwości fizyczne
Chlorek glinu przy ogrzewaniu pod normalnym ciśnieniem sublimuje przy 180 °C. Pod zwiększonym ciśnieniem topi się w temperaturze ok. 192 °C, czemu towarzyszy gwałtowny spadek przewodnictwa elektrycznego i wzrost objętości o 85%. Wynika to ze zmiany struktury podczas przemiany fazowej[4][7].
Właściwości chemiczne
Chlorek glinu reaguje bardzo gwałtownie z wodą tworząc heksahydrat, AlCl
3·6H
2O, hydrolizujący do tlenochlorku glinu, AlClO, i kwasu solnego, w wyniku czego roztwór ma charakter silnie kwasowy[3]. Ogrzewanie heksahydratu prowadzi do wydzielenia chlorowodoru, pary wodnej i tlenku glinu (Al
2O
3)[8].
Zastosowanie
Chlorek glinu stosuje się jako katalizator w syntezie organicznej (np. w reakcji Friedla-Craftsa)[8]:
Jest on również stosowany do wyrobu papieru pergaminowego, a także w garbarstwie i medycynie[8].
Przypisy
- ↑ a b Chlorek glinowy w katalogu Merck Chemicals (pol.). [dostęp 2011-03-07].
- ↑ a b Chlorek glinu (nr 563919) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski.
- ↑ a b c d e f Otto Helmboldt, L. Keith Hudson, Chanakya Misra, Karl Wefers, Wolfgang Heck, Hans Stark, Max Danner, Norbert Rösch. Aluminum Compounds, Inorganic. „Ullmann's Encyclopedia of Industrial Chemistry”, 2007. DOI: 527.pub2 10.1002/14356007.a01 527.pub2.
- ↑ a b c d N. N. Greenwood, A. Earnshaw: Chemistry of the elements. Oxford; New York: Pergamon Press, 1984, s. 262-266. ISBN 0-08-022057-6.
- ↑ a b Chlorek glinu (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2015-04-10].
- ↑ Dale L. Perry: Handbook of inorganic compound. Boca Raton: Taylor Francis, 2011, s. 5. ISBN 978-1-4398-1461-1.
- ↑ a b Adam Bielański: Podstawy chemii nieorganicznej. Wyd. 5. Warszawa: PWN, 2002, s. 789. ISBN 83-01-13654-5.
- ↑ a b c d Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 72, ISBN 83-7183-240-0.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
The hazard symbol for corrosive substances according to directive 67/548/EWG by the European Chemicals Bureau, now known as the Consumer Products Safety and Quality (CPS&Q) Unit.
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Example of a friedel-Crafts-reaction
Autor: Oryginalnym przesyłającym był Victorclaessen z angielskiej Wikipedii, Licencja: CC BY-SA 3.0
Aluminium trichloride hexahydrate, white and yellow