Chlorek tionylu
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | SOCl2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 118,97 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | bezbarwna bądź żółta ciecz o duszącym zapachu dwutlenku siarki[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | 7719-09-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 24386 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | fluorek tionylu (SOF2) bromek tionylu (SOBr2) chlorek sulfurylu (SO2Cl2) fosgen (COCl2) chlorek nitrozylu (ClNO) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||
Chlorek tionylu, SOCl2 – nieorganiczny związek chemiczny z grupy chlorków kwasowych, pochodna kwasu siarkawego. W temperaturze pokojowej jest bezbarwną cieczą, dymiąca na powietrzu. Wykorzystywany w reakcjach chlorowania związków organicznych, m.in. podczas produkcji gazów bojowych.
Budowa i właściwości
Cząsteczka chlorku tionylu ma budowę piramidalną, wskazującą na obecność wolnej pary elektronowej (w przeciwieństwie do COCl2 o budowie płaskiej). Chlorek tionylu reaguje z wodą tworząc chlorowodór i dwutlenek siarki:
- H2O + SOCl2 → 2HCl + SO2
Jest bardzo reaktywny. W temperaturze około 140 °C ulega rozkładowi.
Otrzymywanie
Podstawową metodą przemysłowej syntezy chlorku tionylu jest reakcja trójtlenku siarki z dwuchlorkiem siarki[4]:
- SO3 + SCl2 → SOCl2 + SO2
Inne metody otrzymywania:
- SO2 + Cl2 + SCl2 → 2SOCl2
- SO3 + Cl2 + 2SCl2 → 3SOCl2
Zastosowania
Chemia organiczna
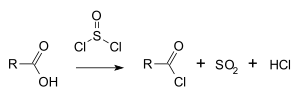
Chlorek tionylu jest szeroko stosowany w reakcjach chlorowania, np. do przekształcania kwasów karboksylowych w chlorki acylowe[5]:
Reaguje z alkoholami dając odpowiednie chlorki alkilowe[6][7]:
W reakcji tej w pierwszym etapie powstaje ester chlorosulfinylowy R−O−SOCl, który rozpada się do chlorku i SO2[8]:
- R−OH + SOCl2 → R−O−SOCl + HCl → R−Cl + SO2
Ze względu na to, że produktami ubocznymi chlorowania za pomocą chlorku tionylu są gazy (HCl i SO2), a nadmiar SOCl2 można usunąć przez destylację, procedura oczyszczania właściwego produktu jest zwykle prostsza niż w przypadku chlorowania za pomocą pięciochlorku fosforu.
Z 1,2-aminoalkoholami reaguje z wytworzeniem cyklicznych sulfamidów, natomiast gdy grupy OH i NH2 są bardziej oddalone, grupa hydroksylowa ulega substytucji atomem chloru, a z aminowej powstaje amid, jak np. w pierwszym etapie otrzymywania bicifadyny (leku przeciwbólowego)[8]:
Chemia nieorganiczna
Chlorek tionylu stosuje się do otrzymywania bezwodnych chlorków metali z soli uwodnionych[9]:
- MCln·mH2O + m SOCl2 → MCln + m SO2 + 2m HCl
Baterie litowe
Chlorek tionylu wykorzystuje się także w ogniwach o zastosowaniach specjalnych. Chlorek tionylu jest składnikiem ogniw litowo-chlorkowo tionylowych jako elektroda dodatnia (katoda), z metalicznym litem jako elektrodą ujemną (anodą). Reakcja zachodząca w czasie rozładowywania ogniwa to[10]:
- 4 Li + 2 SOCl2 → 4 LiCl + S + SO2
Ogniwa te mają wiele zalet nad innymi rodzajami litowych ogniw pierwotnych, między innymi wysoką gęstość energii, szeroki zakres temperatur pracy i dużą trwałość, jednakże ich wysoka cena i kwestie bezpieczeństwa ograniczają ich zastosowanie. Zawartość tych ogniw jest wysoce toksyczna i wymaga specjalnych procedur utylizacji, dodatkowo istnieje ryzyko eksplozji ogniwa w wyniku zwarcia[10].
Przypisy
- ↑ a b c d e f g h Chlorek tionylu (ang.). The Chemical Database. Wydział Chemii Uniwersytetu w Akronie. [dostęp 2012-06-30].[niewiarygodne źródło?]
- ↑ a b c Chlorek tionylu (nr 88952) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski.
- ↑ a b Chlorek tionylu (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2015-04-07].
- ↑ N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, Pergamon Press, 1984.
- ↑ Rutenberg, M. W.; Horning, E. C.. 1-Methyl-3-ethyloxindole. „Org. Synth.”. Coll. Vol. 4, s. 620, 1963.
- ↑ Mondanaro, K. R.; Dailey, W. P.. 3-Chloro-2-(chloromethyl)-1-propene. „Org. Synth.”. Coll. Vol. 10, s. 212, 2004.
- ↑ Krakowiak, K. E.; Bradshaw, J. S.. 4-Benzyl-10,19-diethyl-4,10,19-triaza-1,7,13,16-tetraoxacycloheneicosane. „Org. Synth.”. Coll. Vol. 9, s. 34, 1998.
- ↑ a b Feng Xu, Bryon Simmons, Robert A. Reamer, Edward Corley, Jerry Murry, David Tschaen. Chlorination/cyclodehydration of amino alcohols with SOCl2: An old reaction revisited. „J.Org.Chem.”. 73 (1), s. 312-315, 2008. DOI: 10.1021/jo701877h.
- ↑ A.R. Pray, R.F. Heitmiller, S. Strycker. Anhydrous Metal Chlorides. „Inorganic Syntheses”. 28, s. 321–323, 1990. DOI: 10.1002/9780470132593.ch80.
- ↑ a b Lithium Thionyl Chloride Battery.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The hazard symbol for corrosive substances according to directive 67/548/EWG by the European Chemicals Bureau, now known as the Consumer Products Safety and Quality (CPS&Q) Unit.
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Autor: V8rik z angielskiej Wikipedii, Licencja: GFDL
Alcohol Thionyl Chloride Reaction
Autor: V8rik z angielskiej Wikipedii, Licencja: GFDL
Carbonylic Acid Thionyl Chloride Reaction
Autor: Original uploader was V8rik at en.wikipedia, Licencja: CC-BY-SA-3.0
Bicifadine Synthesis Xu 2007
Structure and dimensions of the thionyl chloride molecule, SOCl2.
The dimensions given are the averages of dimensions determined by microwave spectroscopy and x-ray crystallography.
Microwave spectroscopic data from J. Mol. Struct. (1983) 101 233-238.
X-ray crystallographic data from Acta Cryst. (1988). C44, 926-927.