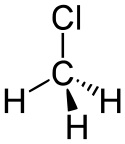
Chlorometan
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | CH3Cl | ||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 50,49 g/mol | ||||||||||||||||||||||||||||||||||||||
| Wygląd | bezbarwny gaz o słodkawym zapachu[1] | ||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||
| Podobne związki | dichlorometan, trichlorometan, tetrachlorometan, fluoroform, bromoform, jodoform | ||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||
Chlorometan, CH
3Cl – organiczny związek chemiczny, najprostszy przedstawiciel chloroalkanów, chlorowa pochodna metanu. Ma właściwości usypiające[3].
Występowanie
Duże ilości chlorometanu powstają w oceanach, gdzie biomasa, pod wpływem światła słonecznego, reaguje z chlorem zawartym w pianie morskiej.
Otrzymywanie
Przemysłowo chlorometan otrzymuje się dwiema metodami[7]:
- w reakcji metanolu z chlorowodorem:
| CH 3OH + HCl → CH 3Cl + H 2O | (1) |
- przez chlorowanie metanu:
| CH 4 + Cl 2 → CH 3Cl + HCl | (2) |
Proces (2) prowadzić można trzema metodami: termiczną, fotochemiczną lub katalityczną[8]. Jest on stosowany coraz rzadziej do produkcji monochlorometanu, gdyż nieuniknione jest powstawanie produktów silniej chlorowanych (CH
2Cl
2, CHCl
3 i CCl
4), podczas gdy w metodzie (1) wykorzystującej metanol, powstaje praktycznie wyłącznie CH
3Cl[9]. Zaletą metody (1) jest też brak chlorowego produktu ubocznego, w przeciwieństwie do (2)[10].
Hydrochlorowanie metanolu (1) może być prowadzone na dwa sposoby[7]:
- reakcja metanolu i chlorowodoru w fazie gazowej, w temperaturze 280–350 °C pod ciśnieniem 5 atm
- reakcja metanolu i kwasu solnego w fazie ciekłej, w temperaturze 120–160 °C; dawniej stosowano przy tym chlorek cynku jako katalizator, jednak współcześnie zwykle nie używa się katalizatora.
Właściwości
W warunkach standardowych chlorometan jest bezbarwnym gazem o słabym słodkawym zapachu[1]. W tych warunkach w wodzie rozpuszcza się w ilości 5,32 g/l[2], a w etanolu, tetrachlorometanie i kwasie octowym – ok. 83–85 g/l[1].
Jest stabilny chemicznie, zaczyna rozkładać się powyżej 400 °C. W temperaturze poniżej 7,5 °C tworzy podobny do śniegu hydrat CH
3Cl·6H
2O. W podwyższonej temperaturze hydrolizuje do metanolu i HCl, przy czym proces ten katalizują zasady, a kwasy nie mają na niego większego wpływu[8].
Ulega reakcjom Wurtza-Fittiga i Friedela-Craftsa, co jest wykorzystywane w przemyśle. Jest czynnikiem metylującym: z alkoholami tworzy etery metylowe, a z aminami wyższe metyloaminy. Z wodorosiarczkiem sodu (NaHS) reaguje w podwyższonej temperaturze i ciśnieniu, dając metanotiol, CH
3SH[8].
Zastosowanie
Jest stosowany jako czynnik chłodzący[3]. Inne zastosowanie znalazł przy produkcji związków ołowiu dodawanych jako środek przeciwstukowy do benzyny, jednak wykorzystanie związków ołowiu w tym charakterze zostało wycofane w większości rozwiniętych krajów.
Chlorometan stanowi produkt pośredni przy wytwarzaniu silikonów. Znajduje również zastosowanie jako rozpuszczalnik przy rafinacji ropy naftowej.
Chlorometan wykorzystywany jest w chemii organicznej do metylowania[3] lub chlorowania. Ma zastosowanie przy produkcji narkotyków, jako środek do miejscowych znieczuleń, jest katalizatorem polimeryzacji niskotemperaturowej, bywa stosowany jako herbicyd.
Historia
Został wytworzony po raz pierwszy w roku 1835 przez francuskich chemików, byli nimi Jean Baptiste André Dumas i Eugene Peligot. Otrzymali oni chlorometan metodą zbliżoną do dzisiejszej, tzn. poprzez ogrzewanie mieszaniny metanolu, kwasu siarkowego i chlorku sodu[11].
Zagrożenia
Opary chlorometanu są odurzające. Objawami zatrucia chlorometanem są: senność, otępienie, trudności w oddychaniu, duszności. W wyższych stężeniach powoduje paraliż i śpiączkę.
Kontakt skóry z ciekłym chlorkiem metylu powoduje odmrożenia. Kontakt chlorometanu z oczami może spowodować pogorszenie wzroku i spowolnienie reakcji oka na światło.
Długotrwałe narażenie na chlorometan wywołuje u myszy defekty płodów, najprawdopodobniej szkodzi również ludzkim płodom, nie potwierdzono tego jednak w sposób przekonujący.
Przypisy
- ↑ a b c d e f g h i j Rossberg i in. 2005 ↓, s. 5.
- ↑ a b c d Methyl chloride, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2012-07-07] (ang.).
- ↑ a b c d Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 74, ISBN 83-7183-240-0.
- ↑ Robert J. Ouellette, J. David Rawn, Organic Chemistry. Structure, Mechanism, and Synthesis, Elsevier, 2014, s. 17, ISBN 1-306-87645-1, OCLC 881509857.
- ↑ Francis A. Carey, Robert M. Giuliano, Organic chemistry, wyd. 8, New York: McGraw-Hill, 2011, s. 29, ISBN 978-0-07-340261-1, OCLC 435711008.
- ↑ a b Chlorometan (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2015-03-28].
- ↑ a b Rossberg i in. 2005 ↓, s. 12–13.
- ↑ a b c Rossberg i in. 2005 ↓, s. 7.
- ↑ Rossberg i in. 2005 ↓, s. 10 i 12.
- ↑ Rossberg i in. 2005 ↓, s. 12.
- ↑ Rossberg i in. 2005 ↓, s. 4.
Bibliografia
- Manfred Rossberg i inni, Chlorinated Hydrocarbons, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, DOI: 10.1002/14356007.a06_233.pub2 (ang.).
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for gas bottles
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
The hazard symbol for flammable/highly flammable substances according to directive 67/548/EWG by the European Chemicals Bureau.
Chloromethane; methyl chloride