Choroba Creutzfeldta-Jakoba
| ||
 Zmiany gąbczaste w obrazie mikroskopowym mózgu pacjenta z CJD | ||
| ICD-10 | A81.0 | |
Choroba Creutzfeldta-Jakoba (ang. Creutzfeldt-Jakob disease, CJD) – choroba neurologiczna z grupy pasażowalnych encefalopatii gąbczastych (TSE), której czynnikiem patogennym są najprawdopodobniej priony. Podobnie jak inne choroby z tej grupy ma charakter neurozwyrodnieniowy i cechuje ją odkładanie w ośrodkowym układzie nerwowym i niektórych innych tkankach nieprawidłowej izoformy białka prionu, PrPSc. CJD występuje w czterech postaciach różniących się przede wszystkim etiologią: sporadycznej (sCJD), rodzinnej (fCJD), jatrogennej (jCJD) i tzw. wariantu choroby (vCJD).
Klasyfikacja
- Samoistna (sporadyczna) choroba Creutzfeldta-Jakoba (ang. sporadic Creutzfeldt-Jakob disease, sCJD) – choroba o charakterystycznym obrazie neuropatologicznym, z obecnymi złogami PrP wykrywanymi immunohistochemicznie lub innymi metodami.
- Przepasażowana choroba Creutzfeldta-Jakoba (jatrogenna) (ang. iatrogenic Creutzfeldt-Jakob disease, jCJD) – postępujący zespół móżdżkowy u chorych leczonych preparatami przysadki mózgowej.
- Rodzinna choroba Creutzfeldta-Jakoba (ang. familial Creutzfeldt-Jakob disease, fCJD) – rzadka choroba neuropsychiatryczna spowodowana odziedziczoną germinalną mutacją genu PRNP kodującego białko prionu PrP.
- Wariant choroby Creutzfeldta-Jakoba (ang. variant Creutzfeldt-Jakob disease, vCJD) – choroba najpewniej spowodowana przepasażowaniem encefalopatii gąbczastej bydła (BSE) na człowieka[1]. Wrażliwość na zakażenie vCJD jest uwarunkowana przez polimorfizm pojedynczego nukleotydu w kodonie 129 genu PRNP; większość chorych na vCJD jest homozygotami 129Met Met, znany jest jeden przypadek heterozygoty[2]. Opisano przypadki wystąpienia po transfuzji krwi[1].
Historycznie w obrębie CJD wyróżniano ponadto zespoły: ataktyczny (zespół Betty Brownell-Oppenheimera), zespół ze ślepotą korową Heidenheina, zespół amiotroficzny (mylony ze stwardnieniem zanikowym bocznym przebiegającym z otępieniem) i panencefalopatyczny.
Historia
Chorobę jako pierwsi opisali niezależnie od siebie Alfons Jakob w 1921 roku[3][4] i Hans Gerhard Creutzfeldt w 1920 roku[5]. Pięć przypadków opisanych przez Jakoba zostało zweryfikowanych histopatologicznie w latach 60. przez Mastersa i Gajduska; trzy z nich nie odpowiadały CJD we współczesnym rozumieniu[6]. Przypadek opisany przez Creutzfeldta nie był przypadkiem sCJD. Rodzinną postać CJD opisał Walter Kirschbaum w 1924 roku[7], a sześć lat później Friedrich Meggendorfer przedstawił pracę opisująca rodzinę Backer, do której należał przypadek Kirschbauma. W 1929 roku Adolf Heidenhain opisał trzy przypadki CJD, którym towarzyszyła ślepota korowa[8]; historycznie wyróżniano te przypadki jako tzw. zespół Heidenheina. Pierwsze przypadki jatrogennej CJD miały miejsce w latach 80., a etiologię choroby wyjaśniono pod koniec dekady. Ogłoszenie nowego wariantu CJD (nvCJD, potem vCJD) miało miejsce w marcu 1996 roku podczas III Sympozjum Chorób Wywołanych przez Priony w Paryżu[9]. Dawniej używane nazwy choroby: zespół Nevina-Jonesa, stwardnienie kurczowe, stwardnienie rzekome; łac. pseudosclerosis spastica, encephalopathia subacuta progressiva.
Epidemiologia
Sporadyczna CJD
90% wszystkich przypadków choroby Creutzfeldta-Jakoba stanowi sCJD. Częstość sCJD szacuje się na 0,5-1:1 000 000 populacji. W Polsce wyliczono częstość na 0,25:1 000 000, co przypuszczalnie odzwierciedla niedodiagnozowanie choroby[10].
Jatrogenna CJD
Jatrogenne przypadki CJD występowały po podawaniu zanieczyszczonego hormonu wzrostu otrzymanego z przysadek mózgowych człowieka. Pojedyncze przypadki wystąpiły po podaniu gonadotropin, przeszczepie opony twardej, zabiegach neurochirurgicznych, przeszczepie rogówki i użyciu elektrod stereotaktycznych. Do dziś przedstawiono na całym świecie około 200 przypadków jCJD.
Wariant CJD
vCJD jest najprawdopodobniej skutkiem przeniesienia encefalopatii gąbczastej bydła (BSE) na człowieka. Wedle konsensusu specjalistów od pasażowalnych chorób prionowych (ang. Spongiform Encephalopathy Advisory Committee, SEAC): „Wobec braku jakiejkolwiek wiarygodnej alternatywy najbardziej prawdopodobne jest, że przypadki tego schorzenia są związane z narażeniem na kontakt z BSE przed wprowadzeniem zakazu stosowania określonych podrobów bydlęcych [ang. Specified Bovine Offal, SBO] w 1989 roku”.
Rodzinna postać CJD
Rodzinna postać CJD (fCJD) spowodowana jest mutacjami w genie PRNP. Za fenotyp fCJD odpowiada kilkanaście mutacji genu PRNP; inne mutacje w tym samym genie powodują chorobę Gertsmanna-Strausslera-Scheinkera (GSS) oraz śmiertelną rodzinną bezsenność (FFI).
Patogeneza CJD i teoria prionu
Według szeroko przyjętej teorii Stanleya B. Prusinera, pasażowalne encefalopatie gąbczaste spowodowane są odkładaniem się w ośrodkowym układzie nerwowym nieprawidłowej izoformy białka prionu PrP. Forma ta (PrPSc albo PrPCJD) tworzy się w wyniku konwersji prawidłowej formy komórkowej (PrPC), kodowanej przez gen człowieka PRNP i ulegającej ekspresji we wszystkich tkankach człowieka. Niewyjaśniony jest mechanizm w jakim prawidłowe białko przybiera konformację charakterystyczną dla białka patologicznego. Obie izoformy mają identyczną sekwencję aminokwasową i są tak samo glikozylowane. Różnią się natomiast strukturą drugorzędową i konformacją przestrzenną, co implikuje istotne różnice fizykochemiczne. PrPC posiada dwie alfa-helisy i dwie beta-nici, natomiast w PrPSc przeważa struktura beta-kartki.
Mutacje punktowe
| Mutacja | Kodon 129 w drugim allelu | Obszar genu | Fenotyp | OMIM | Epidemiologia | |
|---|---|---|---|---|---|---|
| cDNA | Aminokwasy | |||||
| c.T>C | p.Pro68Pro | |||||
| c.C>T | p.Pro102Leu | GSS | 176640.0002 | |||
| c.C>T | p.P105L | Val | GSS | 176640.0015 | Japonia[11] | |
| c.C>A | p.Pro105Thr | |||||
| c.C>T | p.A117V | Val | GSS[12][13] | 176640.0004 | ||
| p.M129V | STPD | 176640.0005 | ||||
| c.T>G | p.Tyr145STOP | Met | GSS | |||
| c.C>T | p.Gln160STOP | Met | CJD | |||
| c.A>G | p.Asn171Ser | Val | Schizofrenia | |||
| p.D178N | Val | CJD | ||||
| p.D178N | Met | CJD, FFI | 176640.0010 | |||
| p.V180I | 176640.0016 | Japonia[14][15] | ||||
| p.Thr183Ala | fCJD | |||||
| c.A>G | p.His187Arg | GSS | ||||
| p.Thr188Arg | ||||||
| p.Thr188Lys | ||||||
| p.Glu196Lys | ||||||
| c.T>C | p.F198S | Val | GSS | 176640.0011 | USA, Indiana[16] | |
| c.G>A | p.E200K | Met | CJD | 176640.0006 | Słowacja[17], Izrael, Chile[18][19] | |
| p.Asp202Asn | GSS | |||||
| p.Val203Ile | ||||||
| c.CGC>CAG | p.Arg208His | Met | sCJD? | 176640.0023 | ||
| c.G>A | p.Val210Ile | 176640.0014 | ||||
| p.Glu211Gln | sCJD | |||||
| p.Gln212Pro | ||||||
| p.Gln212Gln | ||||||
| p.Q217R | GSS | 176640.0012 | Szwecja | |||
| p.Glu219Lys | ||||||
| p.Arg228Arg | ||||||
| p.Ser230Ser | ||||||
| p.Met232Arg | 176640.0017 | |||||
| p.Met232Thr | GSS | |||||
| p.Pro238Ser | ||||||
Insercje
| Ilość dodatkowych wstawek | Łączna liczba wstawek | Sekwencja | Fenotyp |
|---|---|---|---|
| 0 | 5 | R1, R2, R2, R3, R4 | wt |
| (-2) | 3 | R1, R2, R4 | ?[20] |
| 1 | 6 | R1, R2, R2, R2, R3, R4 | ? |
| 2 | 7 | R1, R2, R2, R2a, R2a, R3, R4 | |
| 4 | 9 | R1, R2, R2, R2, R2, R2, R2, R3, R4 | |
| 4 | 9 | R1, R2, R2, R3, R2, R3, R2, R3, R4 | |
| 4 | 9 | R1, R2, R2, R3, R2, R2, R2, R3, R4 | |
| 4 | 9 | R1, R2, R2, R2, R2, R2, R2, R3, R4 | |
| 5 | 10 | R1, R2, R2, R3, R2, R2, R2, R2, R3, R4 | CJD[21] |
| 5 | 10 | R1, R2, R2, R3, R2, R3g, R2, R2, R3, R4 | |
| 5 | 10 | R1, R2, R2, R2a, R2, R2a, R2, R2, R3, R4 | |
| 6 | 11 | R1, R2, R2, R2, R3, R2, R3gR2, R2, R3, R4 | |
| 6 | 11 | R1, R2, R2, R3, R2, R3g, R2, R3g, R2, R3, R4 | |
| 6 | 11 | R1, R2, R2, R3g, R2, R2, R3g, R2, R2, R3, R4 | |
| 6 | 11 | R1, R2, R2, R2, R2, R2, R2, R2, R3g, R3, R4 | |
| 6 | 11 | R1, R2, R2, R2, R2, R2, R2, R2, R2, R3, R4 | |
| 7 | 12 | R1, R2, R2, R2c, R3, R2, R3, R2, R3, R3, R4 | CJD[22] |
| 8 | 13 | R1, R2, R2, R2, R2, R2, R2, R2, R2, R2, R2a, R3, R4 | CJD, GSS[23] |
| 8 | 13 | R1, R2, R2, R3g, R3, R2, R2, R2, R2, R2, R2, R3, R4 | |
| 9 | 14 | R1, R2, R2, R3, R2, R3, R3g, R2, R2a, R2, R3, R2, R3, R4 | ?[24] |
Objawy i przebieg
Klasyczna triada objawów w CJD to otępienie, mioklonie i typowy obraz w EEG. Występują one łącznie u około 70% pacjentów. U około 30% stwierdza się objawy prodromalne: osłabienie, zaburzenia snu i łaknienia. W klasycznej postaci CJD postępujący deficyt neurologiczny i otępienie kończą się śmiercią chorego w 1. roku choroby. Około 5% to przypadki o długim, przewlekłym przebiegu.
W okresie prodromalnym choroby opisywano uporczywy świąd (tzw. prion pruritus)[25].
Wariant CJD
Obraz kliniczny vCJD znacznie się różni od obrazu klinicznego klasycznej postaci CJD. Średnia wieku, w którym nastąpił zgon wynosi 28 lat, w przeciwieństwie do sCJD, przy której jest to 68 lat oraz przebiega dłużej (13-14 miesięcy)[26]. Początkowe objawy to zaburzenia psychiczne (depresja, lęk, dysforia, bezsenność, obsesje, myśli samobójcze), a w około 30% przypadków także objawy czuciowe pod postacią silnego bólu[1][27]. Następnie pojawiają się zaburzenia pamięci, trudności w chodzeniu i koncentracji, niewyraźna mowa, drżenia i parestezje[27]. Charakterystyczne dla vCJD jest to, że objawy neurologiczne pojawiają się później niż psychiczne[26]. W fazie schyłkowej pojawiają się halucynacje, dezorientacja, pląsawica, inkontynencja, mioklonie, a następnie pacjent zapada w mutyzm akinetyczny[1][27].
Diagnostyka
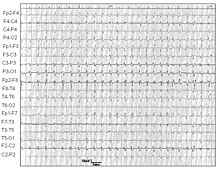
EEG
W 70% przypadków stwierdza się charakterystyczny obraz EEG (kompleksy iglica-fala wolna) na tle zdezorganizowanej czynności podstawowej. W vCJD wyniki badania EEG są całkowicie nieswoiste[9]. Nie obserwuje się charakterystycznych dla sCJD kompleksów iglica-fala wolna[26]. Niekiedy wynik badania EEG jest prawidłowy mimo zmian neurologicznych.
Tomografia komputerowa
Obraz mózgu pacjentów z CJD w tomografii komputerowej jest zazwyczaj prawidłowy. Zasugerowano, że prawidłowy wynik badania CT u pacjenta z otępieniem przemawia za rozpoznaniem CJD[29].
MRI

W vCJD badanie MRI wykazuje hiperintensywny sygnał w poduszce wzgórza (tzw. objaw poduszki, ang. pulvinar sign). Jest to objaw patognomoniczny dla vCJD[30]. W sCJD bardzo intensywny sygnał w projekcji T2 pochodzi z jąder kresomózgowia.
Badania laboratoryjne
W płynie mózgowo-rdzeniowym chorych z sCJD stwierdza się obecność białka 14-3-3. Czułość i swoistość tego objawu szacowana jest na więcej niż 90%. Białko 14-3-3 wykrywane jest metodami Western blotting lub odmianami metody ELISA.
Badanie neuropatologiczne

Klasyczna postać CJD
W badaniu neuropatologicznym w klasycznej postaci CJD stwierdza się triadę objawów:
- zmiany gąbczaste w neuropilu,
- ubytki neuronów,
- reakcje astrocytarną.
Zmiany o takim charakterze obecne są w różnych obszarach mózgowia. Zmiany gąbczaste są patognomoniczne dla całej grupy chorób, do której należy CJD. Niekiedy, w przypadkach o długim przebiegu, zmiany gąbczaste mogą zostać zamaskowane przez zaniki neuronów i astrocytarny rozplem gleju. Zmiany gąbczaste (ang. spongiform change) wymagają różnicowania ze stanem gąbczastym (spongiform state) pojawiającym się przy nasilonym uszkodzeniu kory. Astrocytozę można rozpoznać metodami impregnacyjnymi, takimi jak metoda Cajala albo Holzera. W korze mózgu glejoza włóknista zajmuje głębsze warstwy i towarzyszy zmianom gąbczastym, i dominują w niej formy gemistocytarne astrocytów. W korze móżdżku ma miejsce rozplem gleju Bergmanna i komórek Fañanása (lofogliocytów, gleju pióropuszowego). Niekiedy spotyka się nacieki zapalne wokółnaczyniowe o słabym nasileniu i prawdopodobnie niewielkim znaczeniu patogenetycznym.
Wariant CJD
W obrazie neuropatologicznym vCJD stwierdza się duże ilości patognomonicznych blaszek amyloidowych otoczonych wianuszkowato wakuolami (tzw. blaszki kwitnące, ang. florid plaques)[26]. Blaszki te rozsiane są w korze mózgu i móżdżku, w jądrach kresomózgowia, wzgórzu i podwzgórzu.
Immunohistochemia
Badania immunohistochemiczne z użyciem przeciwciał anty-PrP pozwalają na definitywne rozpoznanie chorób prionowych. Brak ekspresji PrPSc w większości przypadków wyklucza rozpoznanie. Ponieważ przeciwciała nie są swoiste dla PrPSc ani PrPC, zachodzi konieczność usunięcia z badanych tkanek prawidłowej komórkowej izoformy białka. Dokonuje się tego przez autoklawowanie hydrolityczne i wodne, inkubację z kwasem mrówkowym i (lub) inkubację w kuchni mikrofalowej. Immunohistochemia uwidacznia akumulację PrP wokół zmian gąbczastych i wokół wypustek neuronalnych.
Mikroskopia elektronowa
W badaniu ultrastrukturalnym stwierdza się otoczone błoną wakuole gąbczaste wewnątrz elementów neuronalnych, wewnątrz których tworzą się wakuole wtórne, również otoczone błonami (ang. secondary chambers). Wakuole zawierają nieznanego pochodzenia amorficzną treść. W istocie białej znajdują się wakuole śródmielinowe, rozdymające balonowato zmielinizowane włókna nerwowe. Aksony mogą być nienaruszone, ale też obkurczone i szczątkowe.
Rozpoznanie
Rozpoznanie jCJD
Rozpoznanie przepasażowanej (jatrogennej) CJD stawiane jest, gdy stwierdza się:
- Postępujący zespół móżdżkowy u pacjenta leczonego preparatami przysadki mózgowej, lub
- Chorobę odpowiadającą obrazem samoistnej CJD przy jednoczesnym stwierdzeniu czynnika ryzyka (np. przeszczep oponowy)[31].
Rozpoznanie vCJD
| I. | A. Postępująca choroba neuropsychiatryczna B. Przebieg choroby > 6 miesięcy |
| II. | A. Wczesne objawy psychiatryczne (depresja, lęk, apatia, wycofanie, halucynacje) B. Przetrwale objawy bólowe (silny ból, nieprzyjemne dysestezje) |
| III. | A. EEG nie wykazuje typowego dla sCJD wzorca B. W MRI obustronny wzmożony sygnał w poduszce wzgórza |
- Rozpoznanie
- A. Definitywne – IA (postępująca choroba neuropsychiatryczna + neuropatologiczne potwierdzenie vCJD (zmiany gąbczaste i nasilona akumulacja PrP z obecnością blaszek kwitnących w mózgu i móżdżku);
- B. Prawdopodobne – I + 4/5 z II + IIIA + IIIB;
- C. Możliwe – I + 4/5 z II + IIIA.
Przypisy
- ↑ a b c d Wariant choroby Creutzfeldta-Jakoba w bazie WHO, World Health Organization [dostęp 2017-08-12] [zarchiwizowane z adresu 2017-11-15] (ang.).
- ↑ European Centre for Disease Prevention and Control. Creutzfeldt-Jakob disease. In: ECDC. Annual epidemiological report for 2016. Stockholm: ECDC; 2019.
- ↑ Jakob A. Über eigenartige Erkrankungen des Zentralnervensystems mit bemerkenswertem anatomischen Befunde (Spastische Pseudosklerose – Encephalomyclopathie mit disseminirrten Degenerationsherden). „Zeitschrift für die gesamte Neurologie und Psychiatrie”. 64 (1), s. 147-228, 1921. DOI: 10.1007/BF02870932.
- ↑ Jakob A (1923) Spastische Pseudosclerose.[w:] Foerster O, Wilmanns K (ed) Monographien aus dem Gesamtgebiete der Neurologie und Psychiatrie, Die Ekstrapyramidalen Erkrankungen, Vol. 37. Julius Springer, Berlin: 215245
- ↑ Creutzfeldt H.G.. Über eine eigenartige herdförmige Erkrankung des Zentralnervensystems (vorläufige Mitteilung). „Zeitschrift für die gesamte Neurologie und Psychiatrie”. 57, s. 1-18, 1920. DOI: 10.1007/BF02866081.
- ↑ Masters CL, Gajdusek DC (1982) The spectrum of Creutzfeldt-Jakob disease and the virus-induced subacute spongiform encephalopathies In: Smith TJ and Cavanagh JB (ed) Recent Advances in Neuropathology. Edinburgh, Churchill Livingstone: 139163.
- ↑ Kirschbaum W.. Zwei eigenartige Erkrankungen des Zentralnervensystems nach Art der spastischen Pseudosklerose (Jakob). „Zeitschrift für die gesamte Neurologie und Psychiatrie”. 92 (1), s. 175–220, 1924. DOI: 10.1007/BF02877841.
- ↑ Heidenhain A. Klinische und anatomische Untersuchungen über eine eigenartige organische Erkrankung des Zentralnervensystems im Praesenium. „Zeitschrift für die gesamte Neurologie und Psychiatrie”. 118, s. 49–114, 1929. DOI: 10.1007/BF02892896.
- ↑ a b R.G. Will, J.W. Ironside, M. Zeidler, S.N. Cousens i inni. A new variant of Creutzfeldt-Jakob disease in the UK. „Lancet”. 347 (9006), s. 921–925, 1996. DOI: 10.1016/S0140-6736(96)91412-9. PMID: 8598754.
- ↑ a b Paweł P. Liberski: Choroba Creutzfeldta-Jakoba i inne choroby wywołane przez priony – pasażowalne encefalopatie gąbczaste. Lublin: Czelej, 2003. ISBN 83-89309-06-8.
- ↑ Yamada M, Itoh Y, Fujigasaki H, Naruse S, Kaneko K, Kitamoto T, Tateishi J, Otomo E, Hayakawa M, Tanaka J. A missense mutation at codon 105 with codon 129 polymorphism of the prion protein gene in a new variant of Gerstmann-Sträussler-Scheinker disease. „Neurology”. 43. 12, s. 2723-4, 1994. PMID: 7902972.
- ↑ Doh-ura K, Tateishi J, Sasaki H, Kitamoto T, Sakaki Y. Pro----leu change at position 102 of prion protein is the most common but not the sole mutation related to Gerstmann-Sträussler syndrome. „Biochem Biophys Res Commun”. 163. 2, s. 974-9, 1989. PMID: 2783132.
- ↑ Mallucci GR, Campbell TA, Dickinson A, Beck J, Holt M, Plant G, de Pauw KW, Hakin RN, Clarke CE, Howell S, Davies-Jones GA, Lawden M, Smith CM, Ince P, Ironside JW, Bridges LR, Dean A, Weeks I, Collinge J. Inherited prion disease with an alanine to valine mutation at codon 117 in the prion protein gene.. „Brain”. 122 ( Pt 10), s. 1823-37, 1999. PMID: 10506086.
- ↑ Kitamoto T, Ohta M, Doh-ura K, Hitoshi S, Terao Y, Tateishi J. Novel missense variants of prion protein in Creutzfeldt-Jakob disease or Gerstmann-Sträussler syndrome. „Biochem Biophys Res Commun”. 191. 2, s. 709-14, 1993. PMID: 8461023.
- ↑ Jin K, Shiga Y, Shibuya S, Chida K, Sato Y, Konno H, Doh-ura K, Kitamoto T, Itoyama Y. Clinical features of Creutzfeldt-Jakob disease with V180I mutation. „Neurology”. 62. 3, s. 502-5, 2004. PMID: 14872044.
- ↑ Hsiao K, Dlouhy SR, Farlow MR, Cass C, Da Costa M, Conneally PM, Hodes ME, Ghetti B, Prusiner SB. Mutant prion proteins in Gerstmann-Sträussler-Scheinker disease with neurofibrillary tangles. „Nat Genet”. 1. 1, s. 68-71, 1993. DOI: 10.1038/ng0492-68. PMID: 1363810.
- ↑ Goldfarb LG, Mitrová E, Brown P, Toh BK, Gajdusek DC. Mutation in codon 200 of scrapie amyloid protein gene in two clusters of Creutzfeldt-Jakob disease in Slovakia. „Lancet”. 336. 8713, s. 514-5, 1990. PMID: 1975028.
- ↑ Gajdusek DC. The transmissible amyloidoses: genetical control of spontaneous generation of infectious amyloid proteins by nucleation of configurational change in host precursors: kuru-CJD-GSS-scrapie-BSE. Europ J Epidemiol 7: 567-577, 1991.
- ↑ Goldfarb LG, Brown P, Mitrova E, Cervenakova L, Goldin L, Korczyn AD, Chapman J, Galvez S, Cartier L, Rubenstein R, Gajdusek DC. Creutzfeldt-Jacob disease associated with the PRNP codon 200-lys mutation: an analysis of 45 families. Europ J Epidemiol. 7: 477-486, 1991.
- ↑ Beck JA, Mead S, Campbell TA, Dickinson A, Wientjens DP, Croes EA, Van Duijn CM, Collinge J. Two-octapeptide repeat deletion of prion protein associated with rapidly progressive dementia. „Neurology”. 57. 2, s. 354-6, 2001. PMID: 11468331.
- ↑ Cochran EJ, Bennett DA, Cervenáková L, Kenney K, Bernard B, Foster NL, Benson DF, Goldfarb LG, Brown P. Familial Creutzfeldt-Jakob disease with a five-repeat octapeptide insert mutation. „Neurology”. 47. 3, s. 727-33, 1996. PMID: 8797471.
- ↑ Brown P, Goldfarb LG, McCombie WR, Nieto A, Squillacote D, Sheremata W, Little BW, Godec MS, Gibbs CJ, Gajdusek DC. Atypical Creutzfeldt-Jakob disease in an American family with an insert mutation in the PRNP amyloid precursor gene. „Neurology”. 42. 2, s. 422-7, 1992. PMID: 1736177.
- ↑ Goldfarb LG, Brown P, McCombie WR, Goldgaber D, Swergold GD, Wills PR, Cervenakova L, Baron H, Gibbs CJ, Gajdusek DC. Transmissible familial Creutzfeldt-Jakob disease associated with five, seven, and eight extra octapeptide coding repeats in the PRNP gene. „Proc Natl Acad Sci U S A”. 88. 23, s. 10926-30, 1992. PMID: 1683708.
- ↑ Krasemann S, Zerr I, Weber T, Poser S, Kretzschmar H, Hunsmann G, Bodemer W. Prion disease associated with a novel nine octapeptide repeat insertion in the PRNP gene. „Brain Res Mol Brain Res”. 34. 1, s. 173-6, 1997. PMID: 8750875.
- ↑ Thomas B. Fitzpatrick, Irwin M. Freedberg: Fitzpatrick's dermatology in general medicine. New York: McGraw-Hill, Medical Pub. Division, 2003. ISBN 0-07-138076-0.
- ↑ a b c d Wariant choroby Creutzfeldta-Jakoba w bazie CDC, www.cdc.gov [dostęp 2017-08-12] (ang.).
- ↑ a b c Wariant choroby Creutzfeldta-Jakoba w bazie eMedicine, emedicine.medscape.com [dostęp 2017-08-12] (ang.).
- ↑ Kotta K, Paspaltsis I, Bostantjopoulou S, Latsoudis H, Plaitakis A, Kazis D, Collinge J, Sklaviadis T. Novel mutation of the PRNP gene of a clinical CJD case. „BMC Infect Dis”. 6, s. 169, 2006. DOI: 10.1186/1471-2334-6-169. PMID: 17129366.
- ↑ Gálvez S., Cartier L.. Computed tomography findings in 15 cases of Creutzfeldt-Jakob disease with histological verification. „J Neurol Neurosurg Psychiatry”. 47. 11, s. 1244-6, 1985. PMID: 6389776.
- ↑ Tschampa HJ, Zerr I, Urbach H. Radiological assessment of Creutzfeldt-Jakob disease.. „Eur Radiol”. 17. 5, s. 1200-11, 2007. DOI: 10.1007/s00330-006-0456-2. PMID: 17093966.
- ↑ Budka H, Aguzzi A, Brown P, Brucher JM, Bugiani O, Gullotta F, Haltia M, Hauw JJ, Ironside JW, Jellinger K. Neuropathological diagnostic criteria for Creutzfeldt-Jakob disease (CJD) and other human spongiform encephalopathies (prion diseases). „Brain Pathol”. 5. 4, s. 459-66, 1997. PMID: 8974629.
- ↑ Will RG, Zeidler M, Stewart GE, Macleod MA, Ironside JW, Cousens SN, Mackenzie J, Estibeiro K, Green AJ, Knight RS. Diagnosis of new variant Creutzfeldt-Jakob disease. „Ann Neurol”. 47. 5, s. 575-82, 2000. PMID: 10805327.
Bibliografia
- Paweł P. Liberski: Choroba Creutzfeldta-Jakoba i inne choroby wywołane przez priony – pasażowalne encefalopatie gąbczaste. Lublin: Czelej, 2003. ISBN 83-89309-06-8.
- Radzisław Kordek, Jolanta Bratosiewicz-Wąsik, Rafał Grams, Paweł P. Liberski: Pasażowalne encefalopatie gąbczaste - choroby wywoływane przez priony. W: Paweł P. Liberski, Mirosław J. Mossakowski: Neurodegeneracje. T. 1, Biologia molekularna, podstawy strukturalne, choroby neurodegeneracyjne. Warszawa: CUN PAN, 2003, s. 117-162. ISBN 83-88443-26-7.
Linki zewnętrzne
- CREUTZFELDT-JAKOB DISEASE; CJD w bazie Online Mendelian Inheritance in Man (ang.)
- Creutzfeldt-Jakob disease w bazie Who Named It (ang.)
- Polski portal dla rodzin chorych na chorobę Creutzfeldta-Jakoba
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: unknown, Licencja: CC BY 2.0
Konstantia Kotta et al Novel mutation of the PRNP gene of a clinical CJD case. Electroencephalogram of the suspected CJD patient showing typical periodic bursts of triphasic sharp waves.
Histopathologic changes in frontal cerebral cortex of the patient who died of variant Creutzfeldt-Jakob disease in the United States. Marked astroglial reaction is shown, occasionally with relatively large florid plaques surrounded by vacuoles (arrow in inset) (hematoxylin and eosin stain, original magnification ×40).
Autor: Dr Laughlin Dawes, Licencja: CC BY 3.0
This patient presented with a rapidly-progressive dementia, with initial hallucinations and behavioural change. The disease progressed to a mute, akinetic state with myoclonus. Electroencephalogram showed widespread periodic sharp waves.
This diffusion-weighted MR image shows right cortical and striatal high signal, consistent with a diagnosis of sporadic-type Creutzfeldt-Jakob disease (sCJD).Immunohistochemical staining of cerebellar tissue of the patient who died of variant Creutzfeldt-Jakob disease in the United States. Stained amyloid plaques are shown with surrounding deposits of abnormal prion protein (immunoalkaline phosphatase stain, naphthol fast red substrate with light hematoxylin counterstain; original magnification ×158).
Autor: Kotta K et al., Licencja: CC BY 2.0
Immunoblot detection of 14-3-3 in the CSF. The patient was tested positive for the presence of 14-3-3 in the CSF. Lane 1: healthy control, lane 2: patient sample, lane 3: positive control (CSF) and lane 4: positive control (brain tissue homogenate)












