Chytridiomikoza
Chytridiomikoza (chytridiomycosis) – choroba grzybicza skóry spowodowana przez grzyby z rodzaju Batrachochytrium, zwłaszcza Batrachochytrium dendrobatidis. Występuje u wielu gatunków płazów na wszystkich kontynentach, głównie w Ameryce Północnej, Środkowej i Południowej oraz w Australii. Choroba prawdopodobnie pojawiła się w Afryce Subsaharyjskiej w latach 30. XX wieku, a stamtąd rozprzestrzeniła na inne kontynenty[1].
U zarażonych osobników dochodzi do spadku transportu elektrolitów w naskórku o ponad połowę, hipokaliemii i hiponatremii (zmniejszenia stężenia w surowicy krwi jonów potasu o około 20%, a jonów sodu o około 50%), co prowadzi do zatrzymania pracy serca i śmierci[2].
Prawdopodobnie choroba ta spowodowała gwałtowny spadek liczby, a niekiedy całkowite wymarcie wielu gatunków płazów na wielu terenach[3], jak np. Atelopus patazensis[4]. W niektórych przypadkach zarażone zwierzęta mogą jednak żyć stosunkowo długo nie wykazując widocznych objawów choroby[5]. Obecnie nie jest znana przyczyna śmiertelnego przebiegu choroby tylko u niektórych gatunków.
Batrachochytrium dendrobatidis źle toleruje temperatury powyżej 28 °C (w temperaturze 32 °C ginie w 96 godzin, a w temperaturze 37 °C – w cztery godziny), stąd ekspozycja zarażonej żaby na wysoką temperaturę zabija komórki grzyba[6]. Niskie temperatury, podobnie jak stres i działanie szkodliwych substancji chemicznych, osłabiają układ odpornościowy płaza i zmniejszają wydzielanie peptydów antydrobnoustrojowych i przeciwciał, a także przeciwgrzybiczych metabolitów produkowanych przez symbiotyczne bakterie skóry[7]. Przebieg choroby jest podobny w warunkach naturalnych i laboratoryjnych[8]. Przynajmniej niektóre gatunki płazów potrafią nauczyć się unikania patogenu i nabyć na niego oporność. Kontakt z martwymi grzybami może uodpornić na niego zwierzęta. Wystawienie płazów na antygeny Batrachochytrium może być jedną z metod ochrony zagrożonych populacji[9].
Przypisy
- ↑ Piotr Sura, Ewelina Janulis, Piotr Profus. Chytridiomikoza – śmiertelne zagrożenie dla płazów. „Chrońmy Przyrodę Ojczystą”. 66 (6), s. 406–421, 2010.
- ↑ Jamie Voyles, Sam Young, Lee Berger, Craig Campbell, Wyatt F. Voyles, Anuwat Dinudom, David Cook, Rebecca Webb, Ross A. Alford, Lee F. Skerratt, Rick Speare. Pathogenesis of chytridiomycosis, a cause of catastrophic amphibian declines. „Science”. 326 (5952), s. 582–585, 2009. DOI: 10.1126/science.1176765 (ang.).
- ↑ Lee Berger, Rick Speare, Peter Daszak, D. Earl Green, Andrew A. Cunningham, C. Louise Goggin, Ron Slocombe, Mark A. Ragan, Alex D. Hyatt, Keith R. McDonald, Harry B. Hines, Karen R. Lips, Gerry Marantelli, Helen Parkes. Chytridiomycosis causes amphibian mortality associated with population declines in the rain forests of Australia and Central America. „Proceedings of the National Academy of Sciences”. 95 (15), s. 9031–9036, 1998. PMID: 9671799 (ang.).
- ↑ Pablo J. Venegas, Alessandro Catenazzi, Karen Siu-Ting, Jorge Carrillo. Two new harlequin frogs (Anura: Atelopus) from the Andes of northern Peru. „SALAMANDRA – German Journal of Herpetology”. 3 (44), s. 163–176, 2008. ISSN 0036-3375 (ang.).
- ↑ Scott Carver, Ben D. Bell, Bruce Waldman. Does chytridiomycosis disrupt amphibian skin function?. „Copeia”. 2010 (3), s. 487–495, 2010. DOI: 10.1643/CH-09-128 (ang.).
- ↑ Douglas C. Woodhams, Ross A. Alford, Gerry Marantelli. Emerging disease of amphibians cured by elevated body temperature. „Diseases of Aquatic Organisms”. 55, s. 65–67, 2003. PMID: 12887256 (ang.).
- ↑ Louise A. Rollins-Smith, Jeremy P. Ramsey, James D. Pask, Laura K. Reinert, Douglas C. Woodhams. Amphibian immune defenses against chytridiomycosis: Impacts of changing environments. „Integrative and Comparative Biology”. 51 (4), s. 552–562, 2011. DOI: 10.1093/icb/icr095 (ang.).
- ↑ Jamie Voyles, Vance T. Vredenburg, Tate S. Tunstall, John M. Parker, Cheryl J. Briggs, Erica Bree Rosenblum. Pathophysiology in mountain yellow-legged frogs (Rana muscosa) during a chytridiomycosis outbreak. „PLoS ONE”. 7 (4): e35374, 2012. DOI: 10.1371/journal.pone.0035374 (ang.).
- ↑ Taegan A. McMahon i inni. Amphibians acquire resistance to live and dead fungus overcoming fungal immunosuppression. „Nature”. 511, s. 224–227, 2014. DOI: 10.1038/nature13491 (ang.).
Media użyte na tej stronie
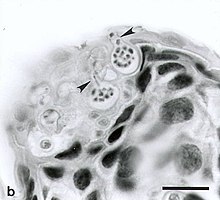
Chytridiomycosis. Ventral skin of upper hind limb of Atelopus varius from western Panama. Two sporangia (spore-containing bodies of Batrachochytrium sp.) containing numerous zoospores are visible within cells of the stratum corneum. Each flask-shaped sporangium has a single characteristic discharge tube (arrow) at the skin surface. Exiting zoospores are visible in the discharge tubes of both sporangia. Hyperkeratosis is minimal in this acute infection. Tissues were fixed in neutral-buffered 10% formalin, paraffin-embedded, sectioned at 6 µm thick and stained with hematoxylin and eosin. Bar = 35 µm.
Autor: Jamie Voyles, Vance T. Vredenburg, Tate S. Tunstall, John M. Parker, Cheryl J. Briggs, Erica Bree Rosenblum, Licencja: CC BY 2.5
Wygląd żaby Rana muscosa chorej na chytridiomycosis, obserwowanej w basenie Sixty Lakes, w górach Sierra Nevada w Kalifornii. Żaba wykazuje kliniczne objawy ciężkiej chytridiomycosis, w tym nienormalną postawę ciała.