Cyjan (związek chemiczny)
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C2N2 | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | (CN) | ||||||||||||||||||||||||||||||||
| Masa molowa | 52,03 g/mol | ||||||||||||||||||||||||||||||||
| Wygląd | |||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||
Cyjan (stgr. κυάνεος – niebieski) – nieorganiczny związek chemiczny z grupy pseudohalogenów. Jest bezbarwnym, silnie trującym gazem o zapachu gorzkich migdałów[3].
Otrzymywanie
Poprzez ogrzewanie cyjanku rtęci(II), w wyniku czego (CN)
2 zmienia się w brunatnawe ciało stałe[3], „paracyjan” (jest on najprawdopodobniej produktem polimeryzacji cyjanu):
- Hg(CN)
2 → Hg + (CN)
2
Poprzez ogrzewanie mieszaniny Hg(CN)
2 i HgCl
2 (reakcja przebiega w niższej temperaturze niż dla czystego cyjanku i tworzy się mniej paracyjanu):
- Hg(CN)
2 + HgCl
2 → Hg
2Cl
2 + (CN)
2
Mieszając stężone roztwory siarczanu miedzi(II) z cyjankiem potasu. Wytrąca się żółty osad cyjanku miedzi(II) Cu(CN)
2, który rozkłada się na cyjanek miedzi(I) CuCN i (CN)
2:
- CuSO
4 + 2KCN → Cu(CN)
2 + K
2SO
4- 2Cu(CN)
2 → 2CuCN + (CN)
2 - 2Cu(CN)
Odwadniając szczawian amonu lub amid kwasu szczawiowego przy użyciu dekatlenku tetrafosforu:
- (CONH
2)
2 → (CN)
2 + 2H
2O
Właściwości
Spala się charakterystycznym niebieskim płomieniem o czerwonej otoczce[3]. Związek ten, ze względu na brak wodoru w cząsteczce ma bardzo wysoką temperaturę spalania w tlenie (około 4000 °C).
Ulega polimeryzacji do brunatnego ciała stałego, rozpuszczalnego w wodzie i etanolu. W zasadach dysproporcjonuje do jonów: cyjankowych (CN−
) i izocyjanianowych (OCN−
)[3].
Przypisy
- ↑ a b Henri A. Favre, Warren H. Powell, Nomenclature of Organic Chemistry. IUPAC Recommendations and Preferred Names 2013 (Blue Book), Royal Society of Chemistry, International Union of Pure and Applied Chemistry, 2014, s. 902, DOI: 10.1039/9781849733069, ISBN 978-0-85404-182-4 (ang.).
- ↑ a b c d e f g h i j k l m Oxalonitrile, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 38430 [dostęp 2017-02-07] (niem. • ang.).
- ↑ a b c d e Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 96, ISBN 83-7183-240-0.
- ↑ a b c d e f g CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 3-130, 6-69, ISBN 978-1-4987-5429-3 (ang.).
- ↑ a b c Cyanogen, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2017-02-07] (ang.).
- ↑ oxalonitrile (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2017-02-07].
Media użyte na tej stronie
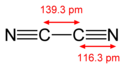
Structure of the cyanogen molecule, NCCN, with the C-N bond length of 1.163 Å and the C-C bond length of 1.393 Å. Data from CRC Handbook of Chemistry and Physics, 88th edition.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for gas bottles
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances