Cykloheksan
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C6H12 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 84,16 g/mol | ||||||||||||||||||||||||||||||||||||
| Wygląd | łatwopalna, przezroczysta, bezbarwna ciecz[1] | ||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||
Cykloheksan – organiczny związek chemiczny, nasycony węglowodór alicykliczny zawierający sześć atomów węgla.
Właściwości fizyczne
W temperaturze pokojowej jest to bezbarwna, łatwopalna ciecz, bardzo słabo rozpuszczająca się w wodzie. Cykloheksan jest rozpuszczalnikiem olejów, tłuszczów, wosków i żywic.
Wytwarzanie
Cykloheksan otrzymuje się w destylacji niektórych gatunków ropy naftowej. Syntetycznie można go uzyskać przez katalityczne uwodornienie benzenu.
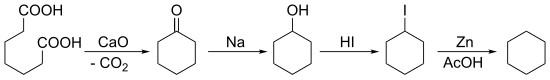
Znane są też dwie historyczne metody syntezy cykloheksanu. Pierwsza, opracowana przez Baeyera w 1894 roku, oparta jest na kondensacji Dieckmanna, w której substratem jest kwas pimelinowy:
Drugą metodę opracowali E. Haworth i W.H. Perkin jr. w tym samym roku i została oparta na reakcji Wurtza, w której substratem był 1,6-dibromoheksan:
Zastosowania
Cykloheksan jest popularnym rozpuszczalnikiem apolarnym. Znajduje zastosowanie w syntezie organicznej, w reakcjach, w których nie można stosować rozpuszczalników zawierających grupy metylowe. Jest też wykorzystywany jako rozpuszczalnik w szeregu spektroskopowych metod identyfikacji związków chemicznych.
Cykloheksan stosowany jest w syntezie poliamidowych włókien sztucznych.
Stereochemia
Czterowiązalne atomy węgla (w hybrydyzacji sp³) wymagają, by ich podstawniki tworzyły czworościan (hipoteza van't Hoffa i Le Bella)[a]. Pierścień sześciowęglowy spełniający takie wymagania musi być niepłaski. Możliwych jest pięć różnych ułożeń atomów węgla, przy których takie czworościenne otoczenie jest zachowane.
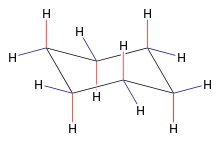
Najstabilniejszą, trwałą w temperaturze pokojowej konformacją pierścienia cykloheksanowego jest konformacja krzesłowa. W temperaturze pokojowej istnieje stan równowagi między dwoma konformacjami krzesłowymi, które są lustrzanymi odbiciami. W procesie przejścia jednego krzesła w drugie (tzw. inwersji pierścienia) stanami przejściowymi są pozostałe konformacje cykloheksanu (również niepłaskie): pół-krzesła, skręconej łódki, i łódki.
Wprowadzenie podstawników do pierścienia cykloheksanu może w znacznym stopniu zaburzyć geometrię pierścienia i szybkość przekształceń konformacyjnych.
Nierównocenność atomów wodoru w cykloheksanie
Atomy wodoru w cykloheksanie nie są równocenne. W cząsteczce tej można wyróżnić dwie grupy wodorów, różniące się istotnie właściwościami – tak reaktywnością, jak i właściwościami spektroskopowymi. Atomy aksjalne, połączone są ze szkieletem węglowym wiązaniami równoległymi do sześciokrotnej osi symetrii cząsteczki. Pozostałe nazywane są ekwatorialnymi.
Konsekwencją nierównocenności atomów wodoru w cykloheksanie jest izomeria geometryczna tzw. aksjalno-ekwatorialna jego pochodnych.
Uwagi
- ↑ Jest to równoznaczne z kątami pomiędzy wiązaniami R−C−R wynoszącymi 109,5°.
Przypisy
- ↑ Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- ↑ a b c d e Haynes 2016 ↓, s. 3-132.
- ↑ Haynes 2016 ↓, s. 5-174.
- ↑ a b c d Haynes 2016 ↓, s. 15-15.
- ↑ a b Haynes 2016 ↓, s. 5-145.
- ↑ a b c Haynes 2016 ↓, s. 6-69.
- ↑ Haynes 2016 ↓, s. 6-244.
- ↑ Haynes 2016 ↓, s. 6-191.
- ↑ a b c Cyclohexane, karta charakterystyki produktu Sigma-Aldrich, Merck KGaA, 26 lipca 2021, numer katalogowy: 650455 [dostęp 2022-06-24]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b Cyclohexane, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2022-06-24] (ang.).
- ↑ Cyclohexane, [w:] CAMEO Chemicals [online], National Oceanic and Atmospheric Administration [dostęp 2022-06-24] (ang.).
Bibliografia
- CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, ISBN 978-1-4987-5429-3 (ang.).
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Chemical structure of cyclohexane, with indication of axial (red) and equatorial (blue) bonds by colors.
Chair conformation of cyclohexane
Cyclohexane synthesis from pimelic acid
Skeletal formula of cyclohexane
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Cyclohexane chair flip (ring inversion) reaction. Structures of the significant conformations (A, B, C & D) of the reaction are shown & plotted against their energy differences (not total energies). Inversion happens quickly & constantly in room temperature.
Conformations:
A: chair
B: twist-boat
C: boat
D: half-chair
Valleys of the pink graph are conformations lowest in energy (shown as A & B). Peaks are conformations highest in energy (shown as C & D). Energies are A<B<C<D with D highest & A lowest in energy. A is thus the most stable conformation &, of all the other conformations, occurs most often in room temperature.
Valleys A & B are local energy minima & A is global minima. A & B can thus be classified as conformers. Peaks are not conformers. Energy differences are mostly caused by anglular strain.
Source for conformer classification:
- Pure & Appl. Chem., Vol. 68, No. 12, pp. 2193-2222, 1996
Source for the relative energy differences & other info in this description:
- J Clayden, N Greeves, SG Warren (2001). Organic chemistry. (2nd ed.). p. 373. ISBN 9780191666216.
Cyclohexane synthesis from 1,6-dibromohexane (Harworth, Perkin)