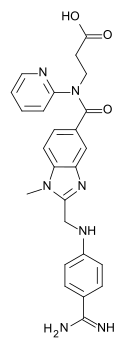
Dabigatran
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||
| Wzór sumaryczny | C34H41N3O7S | ||||||||||||||||||
| Masa molowa | 627,7[1] g/mol | ||||||||||||||||||
| Wygląd | białe kryształki[2] | ||||||||||||||||||
| Identyfikacja | |||||||||||||||||||
| Numer CAS | 211914-51-1 | ||||||||||||||||||
| PubChem | 216210 | ||||||||||||||||||
| DrugBank | DB14726 | ||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||
| ATC | B01AE07 | ||||||||||||||||||
| Stosowanie w ciąży | kategoria C[4] | ||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
Dabigatran (łac. dabigatranum) – wielofunkcyjny organiczny związek chemiczny, lek przeciwzakrzepowy, bezpośredni i odwracalny inhibitor trombiny, stosowany w zapobieganiu zakrzepom u pacjentów z grup wysokiego ryzyka.
Mechanizm działania
Dabigatran jest bezpośrednim i odwracalnym inhibitorem trombiny[6]. Hamuje trombinę wolną i związaną z fibryną, a także agregację płytek krwi związanych z trombiną[6]. Lek jest podawany w postaci proleku eteksylanu dabigatranu, który jest nieaktywny biologicznie, ale po wchłonięciu w procesie hydrolizy ulega przekształceniu do postaci aktywnej[6].
Zastosowanie
Unia Europejska
- Zapobieganie żylnej chorobie zakrzepowo-zatorowej u dorosłych pacjentów po przebytej planowej endoprotezoplastyce stawu biodrowego lub kolanowego[5],
- zapobieganie udarom mózgu i zatorowości obwodowej u dorosłych pacjentów z migotaniem przedsionków niezwiązanym z wadą zastawkową z jednym lub kilkoma czynnikami ryzyka, takimi jak zastoinowa niewydolność serca, nadciśnienie tętnicze, wiek ≥ 75 lat, cukrzyca, udar lub przemijający napad niedokrwienny w wywiadzie[5],
- leczenie zakrzepicy żył głębokich oraz zatorowości płucnej u dorosłych[5],
- zapobieganie nawrotom zakrzepicy żył głębokich oraz zatorowości płucnej u dorosłych[5].
Stany Zjednoczone
- Zmniejszenie ryzyka wystąpienia udaru mózgu i zatorowości systemowej u pacjentów z migotaniem przedsionków niezwiązanym z wadą zastawkową[4].
Dabigatran znajduje się na wzorcowej liście podstawowych leków Światowej Organizacji Zdrowia (WHO Model Lists of Essential Medicines) (2019)[7].
Dabigatran jest dopuszczony do obrotu w Polsce (2020)[8].
Działania niepożądane
Dabigatran może powodować następujące działania niepożądane u ponad 1% pacjentów: zmniejszenie stężenia hemoglobiny, niedokrwistość, krwiak, krwawienie z przewodu pokarmowego, krwiomocz[5].
Dawkowanie
Zalecane dawkowanie dabigatranu[5]:
- w zapobieganiu żylnej chorobie zakrzepowo-zatorowej u dorosłych pacjentów po przebytej planowej endoprotezoplastyce stawu biodrowego – 220 mg przez 10 dni (początkową dawkę 110 mg należy przyjąć w ciągu 1 do 4 godzin od zakończenia zabiegu chirurgicznego),
- w zapobieganiu żylnej chorobie zakrzepowo-zatorowej u dorosłych pacjentów po przebytej planowej endoprotezoplastyce stawu kolanowego – 220 mg przez 28–35 dni (początkową dawkę 110 mg należy przyjąć w ciągu 1 do 4 godzin od zakończenia zabiegu chirurgicznego, pod warunkiem utrzymanej hemostazy),
- w zapobieganiu udarom mózgu i zatorowości obwodowej u dorosłych pacjentów z migotaniem przedsionków niezwiązanym z wadą zastawkową z jednym lub kilkoma czynnikami ryzyka, takimi jak zastoinowa niewydolność serca, nadciśnienie tętnicze, wiek ≥ 75 lat, cukrzyca, udar lub przemijający napad niedokrwienny w wywiadzie – 150 mg dwa razy na dobę,
- w leczeniu zakrzepicy żył głębokich oraz zatorowości płucnej – 150 mg dwa razy na dobę, po terapii lekiem przeciwzakrzepowym podawanym pozalitowo przez co najmniej 5 dni,
- w zapobieganiu zakrzepicy żył głębokich oraz zatorowości płucnej – 150 mg dwa razy na dobę.
U pacjentów powyżej 75 roku życia należy rozważyć zmniejszenie dawki, natomiast u pacjentów powyżej 80 roku życia należy pojedynczą dawkę zmniejszyć ze 150 mg na 110 mg[5].
Przypisy
- ↑ Dabigatran, [w:] PubChem [online], United States National Library of Medicine, CID: 216210 [dostęp 2020-10-28] (ang.).
- ↑ a b c Dabigatran, [w:] DrugBank [online], University of Alberta, DB14726 [dostęp 2020-10-28] (ang.).
- ↑ Dabigatran SC-481166 (ang.). Santa Cruz Biotechnology. [dostęp 2020-10-28].
- ↑ a b PRADAXA (dabigatran etexilate mesylate) capsules for oral use. Agencja Żywności i Leków, 2010. [dostęp 2020-10-28].
- ↑ a b c d e f g h i j k l Boehringer Ingelheim International GmbH: Pradaxa kapsułki twarde. Charakterystyka Produktu Leczniczego. Europejska Agencja Leków, 2011. [dostęp 2020-10-28].
- ↑ a b c Jan Podlewski, Alicja Chwalibogowska-Podlewska: Encyklopedia Leki Współczesnej Terapii. Wyd. XXII. Warszawa: Medical Tribune Polska, 2019, s. 228-229. ISBN 978-83-951310-6-6.
- ↑ WHO Model List of Essential Medicines 21th List (ang.). Światowa Organizacja Zdrowia, 2019. [dostęp 2020-10-28].
- ↑ Obwieszczenie Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych z dnia 8 lipca 2020 r. w sprawie ogłoszenia Urzędowego Wykazu Produktów Leczniczych Dopuszczonych do Obrotu na terytorium Rzeczypospolitej Polskiej. Dziennik Urzędowy Ministra Zdrowia, 2020-07-20. [dostęp 2020-10-28].
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.