Dichromian amonu
| |||||||||||||||||||||||||||||||||
 próbka związku | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||
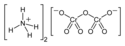
| Wzór sumaryczny | (NH 4) 2Cr 2O 7 | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | (NH 4) 2[Cr 2O 6(μ-O)] | ||||||||||||||||||||||||||||||||
| Masa molowa | 252,06 g/mol | ||||||||||||||||||||||||||||||||
| Wygląd | pomarańczowoczerwone kryształy[1] | ||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||
| Numer CAS | 7789-09-5 | ||||||||||||||||||||||||||||||||
| PubChem | 24600 | ||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Inne aniony | dichromian potasu | ||||||||||||||||||||||||||||||||
| Inne kationy | chromian amonu, siarczan amonu, azotan amonu | ||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||
Dichromian amonu (nazwa Stocka: dichromian(VI) amonu), (NH
4)
2Cr
2O
7 – nieorganiczny związek chemiczny z grupy dichromianów, sól kwasu dichromowego i amoniaku.
Otrzymywanie
Otrzymywany jest w reakcji kwasu chromowego i wody amoniakalnej.
Właściwości
Dichromian amonu tworzy pomarańczowe kryształy, dobrze rozpuszczalne w wodzie. Jest silnym utleniaczem i reaguje, często dość gwałtownie, z wszystkimi reduktorami. Jego cząsteczka, oprócz jonu dichromianowego o właściwościach utleniających, zawiera jon amonowy o właściwościach redukujących, co czyni ją niestabilną. Pod wpływem ogrzania ulega gwałtownemu rozkładowi z wydzielaniem dużej ilości puszystego zielonego tlenku chromu(III) i produktów gazowych:
- (NH
4)
2Cr
2O
7 → Cr
2O
3 + N
2↑ + 4H
2O↑
Reakcja ta wykorzystywana jest w pokazie pirotechnicznym chemiczny wulkan[6]. Rozkład termiczny w szczelnych pojemnikach może prowadzić do eksplozji[7].
Zastosowanie
Stosuje się go w pirotechnice, fotografii, jak również w litografii, jako źródło czystego azotu w laboratorium oraz jako katalizator. Wykorzystuje się go też jako zaprawy pigmentowej, jak również w syntezie alizaryny, garbarstwie i oczyszczaniu olei.
Zagrożenia
Dichromian amonu jest rakotwórczy (grupa 1 według Międzynarodowej Agencji Badań nad Rakiem)[3].
Wypadki
W roku 1986 w firmie Diamond Shamrock Chemicals w Ashtabuli w wyniku wybuchu ok. tony dichromianu amonu, który był suszony w nagrzewnicy, śmierć poniosły dwie osoby, a kolejnych 14 zostało rannych[8].
Przypisy
- ↑ a b c d CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 4-46, ISBN 978-1-4987-5429-3 (ang.).
- ↑ Dichromian amonu (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2018-08-12].
- ↑ a b c Dichromian amonu (nr 450138) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2018-08-12]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Dichromian(VI) amonu, międzynarodowa karta bezpieczeństwa chemicznego, Międzynarodowa Organizacja Pracy [dostęp 2018-08-12] (pol. • ang.).
- ↑ Dichromian amonu, [w:] CAMEO Chemicals [online] [dostęp 2018-08-12] (ang.).
- ↑ Will S. Deloach, John W. McHugh, Jerry Black, An ammonium dichromate “volcano”, „Journal of Chemical Education”, 28 (12), 1951, s. 649, DOI: 10.1021/ed028p649 (ang.).c?
- ↑ Jay A. Young, Ammonium Dichromate, „Journal of Chemical Education”, 82 (11), 2005, s. 1617, DOI: 10.1021/ed082p1617 (ang.).c?
- ↑ Stewart Diamond, Chemical in blast was being heated, „The New York Times”, 19 stycznia 1986, s. 22 [dostęp 2012-02-12].
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
(NH4)2Cr2O7
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Structural formula of ammonium dichromate, [NH4]2[Cr2O7].
Structure drawn in ChemBioDraw Ultra 12.0.Autor: Mikk Mihkel Vaabel, Licencja: CC BY-SA 3.0
Ammooniumdikromaadi lagundamise käigus tekib omanäoline "vulkaan". Antud katse on sooritatud ammooniumdikromaadi süütamisel tikuga. Reaktsioonivõrrand - (NH4)2Cr2O7 —t–> Cr203 + N2 + 4H2O