Difluorek tlenu
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||
| Wzór sumaryczny | OF2 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 54,00 g/mol | ||||||||||||||||||||||||
| Wygląd | bezbarwny gaz o mdłym zapachu[2] | ||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||
| Numer CAS | 7783-41-7 | ||||||||||||||||||||||||
| PubChem | 24547 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||
| Podobne związki | woda, tlenek chloru(I) | ||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||
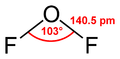
Difluorek tlenu, OF
2 – nieorganiczny związek chemiczny z grupy fluorków, w którym tlen znajduje się na II stopniu utlenienia.
W temperaturze pokojowej jest to bezbarwny gaz, rozpuszczalny w wodzie. Reaguje wybuchowo z parą wodną zgodnie ze schematem:
- OF
2 + H
2O → 2HF + O
2
W temperaturze powyżej 260 °C rozkłada się na pierwiastki składowe.
Otrzymywany przez działanie fluorem na rozcieńczony roztwór wodorotlenku sodu:
- 2F
2 + 2NaOH → 2NaF + H
2O + OF
2
Difluorek tlenu można otrzymywać w sposób ciągły. Do zamkniętego naczynia wprowadza się od dołu wodny roztwór wodorotlenku sodowego, a poprzez dodatkową rurkę z góry – gazowy fluor na dno naczynia. Otworem z boku, w połowie wysokości naczynia, uchodzi wodny roztwór fluorku sodowego, zaś gazowy fluorek tlenu jeszcze jednym wyprowadzeniem na górze naczynia. Przy 4% roztworze wodorotlenku sodowego wydajność reakcji wynosi ok. 15%.
Przypisy
- ↑ a b Neil G. Connelly i inni, Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005 (Red Book), International Union of Pure and Applied Chemistry, RSC Publishing, 2005, s. 320, ISBN 978-0-85404-438-2 (ang.).
- ↑ a b c d e f g h Oxygen difluoride (ZVG: 570242) (ang. • niem.) w bazie GESTIS, Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA). [dostęp 2015-11-06].
- ↑ D.M. Yost: Oxygen Fluoride. W: Harold Simmons Booth: Inorganic Syntheses. T. 1. 1939, s. 109–111.
Linki zewnętrzne
Media użyte na tej stronie
Ball-and-stick model of the oxygen difluoride molecule, OF2.