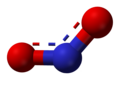
Dwutlenek azotu
| |||||||||||||||||||||||||||||||||||||||||||||||
 Gazowy NO2 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | NO2 | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 46,01 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | brunatny gaz | ||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||
Dwutlenek azotu (nazwa Stocka: tlenek azotu(IV)), NO
2 – nieorganiczny związek chemiczny z grupy tlenków azotu, w którym azot występuje na IV stopniu utlenienia. W temperaturze pokojowej jest to brunatny, silnie toksyczny gaz o ostrym zapachu przypominającym zapach gazowego chloru.
W temperaturze poniżej 147 °C zaczyna ulegać spontanicznej dimeryzacji do bezbarwnego tetratlenku diazotu:
- 2NO
2 ⇌ N
2O
4
Ze spadkiem temperatury stopień dimeryzacji rośnie. W temperaturze 27 °C zawartość NO
2 wynosi ok. 20%, a w temperaturze krzepnięcia, tj. w ok. −9 °C w układzie jest go ok. 0,7%.
Na skalę techniczną dwutlenek azotu otrzymuje się w wyniku spontanicznego utlenienia tlenku azotu tlenem. Tlenek azotu otrzymuje się wcześniej w reakcji utleniania amoniaku.
Dwutlenek azotu jest tlenkiem kwasowym i w reakcji z wodą tworzy równomolową mieszaninę kwasu azotowego i kwasu azotawego. Ma silne właściwości utleniające – utlenia wiele metali przejściowych, np. żelazo i miedź, tworząc odpowiednie tlenki tych metali i tlenek azotu, NO.
Z halogenami tworzy związki nazywane halogenkami nitrylu, np. NO
2Cl i NO
2F, które z kolei są używane niekiedy jako odczynniki do otrzymywania organicznych nitrozwiązków.
VSEPR
Obliczenie liczby przestrzennej dla dwutlenku azotu według metody VSEPR daje wartość 2,5, co zaokrągla się do 3. W efekcie dla cząsteczki NO
2 przyjmuje się hybrydyzację sp2 (XR
2E – budowa kątowa). Powodem takiej sytuacji jest fakt, iż NO
2 jest rodnikiem, czyli oprócz wiązań z tlenem, ma jeden wolny elektron. Wynika z tego stosunkowo duża reaktywność chemiczna oraz silne zabarwienie.
Oddziaływanie na organizm człowieka
Nawet krótkotrwały kontakt z substancją powoduje podrażnienie układu oddechowego, podrażnienie oczu oraz kaszel[8]. Ponieważ dwutlenek azotu ma właściwości utleniające, powoduje utlenienie Fe2+ zawartego w hemoglobinie do Fe3+, w efekcie czego hemoglobina traci zdolność do przenoszenia tlenu. Na zatrucie szczególnie narażeni są pracownicy silosów, gdyż dwutlenek azotu powstaje w wyniku rozkładu białek zawierających azot (choroba silosowa) oraz pozostali pracownicy zajmujący się otrzymywaniem i wykorzystywaniem kwasu azotowego[9]. Gaz ten występuje również w zanieczyszczonym przez transport i przemysł powietrzu i odpowiada za charakterystyczną barwę smogu[10]. U osób mieszkających w zanieczyszczonych miastach mogą wystąpić problemy z oddychaniem i choroby płuc[11].
Przypisy
- ↑ a b Nitrogen dioxide, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 1090 [dostęp 2011-06-24] (niem. • ang.).
- ↑ a b Lide 2009 ↓, s. 4-79
- ↑ a b Lide 2009 ↓, s. 6-52
- ↑ Lide 2009 ↓, s. 9-51
- ↑ a b Dwutlenek azotu (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2015-04-07].
- ↑ Ditlenek azotu (nr 295582) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2011-06-24]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Dwutlenek azotu (nr 295582) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Stanów Zjednoczonych. [dostęp 2011-06-24]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Czemu i w jakim stopniu szkodzi dwutlenek azotu – Blaue-Plakette.de, www.blaue-plakette.de [dostęp 2019-04-13] (pol.).
- ↑ Toksyczność tlenków azotu a bezpieczeństwo pracy - Artykuły - Laboratoria.net, laboratoria.net [dostęp 2019-04-13] (pol.).
- ↑ Czym się różni smog fotochemiczny od kwaśnego?, Airly [dostęp 2019-04-13] (pol.).
- ↑ Czym truje nas smog? Tlenki azotu (#1) - SmogLab, smoglab.pl [dostęp 2019-04-13] (pol.).
Bibliografia
- Adam Bielański: Podstawy chemii nieorganicznej. Cz. 2. Warszawa: PWN, 1994, s. 660–661. ISBN 83-01-06542-7.
- David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, ISBN 978-1-4200-9084-0 (ang.).
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Autor: Uwe W., Licencja: CC BY-SA 2.0 de
Dinitrogen Tetroxide as dimer of Nitrogen dioxide
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Autor: Fabexplosive, Licencja: CC-BY-SA-3.0
Nitrogen dioxide obtained in a test-tube
Autor: Eframgoldberg, Licencja: CC BY-SA 3.0
An overlay of the same 99.9% pure NO2/N2O4 sealed in an ampoule. From left to right -196 °C, 0 °C, 23 °C, 35 °C, 50 °C
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for gas bottles
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.