Dystrofia mięśniowa Duchenne’a
| Dystrophia progressiva pseudohypertrophica | |
| ICD-10 | |
|---|---|
Choroba Duchenne’a, dystrofia mięśniowa Duchenne’a/Beckera (łac. dystrophia progressiva pseudohypertrophica, DMD/BMD) – choroba genetyczna powodująca postępującą i nieodwracalną dystrofię (zanik) mięśni. Jest to najczęściej spotykana forma dystrofii mięśniowej. Po raz pierwszy została opisana przez francuskiego neurologa Guillaume’a Benjamina Amanda Duchenne’a w roku 1861.
Występowanie
Dystrofia mięśniowa Duchenne’a/Beckera to najczęstsza prowadząca do śmierci dziedziczona recesywnie choroba sprzężona z płcią[1][2]. Częstość występowania wynosi ok. 1:3500 urodzeń chłopców. Łagodniejsza postać – dystrofia mięśniowa Beckera (BMD) występuje z częstością ok. 1:18 000. Ze względu na sposób dziedziczenia zapadają na nią niemal wyłącznie chłopcy – istnieją pojedyncze przypadki wystąpienia DMD u dziewczynek z zespołem Turnera (jeden chromosom X)[3]. W ⅔ przypadków DMD/BMD jest skutkiem mutacji przekazywanej synowi przez matkę, która jest nosicielką defektywnego genu recesywnego, w pozostałych choroba wywołana jest nowo powstałą mutacją. Spotyka się także przypadki mozaicyzmu germinalnego.
Przyczyna
Obie postacie choroby uwarunkowane są uszkodzeniem w allelu recesywnym położonym na chromosomie X (prążek Xp21). Są to różne mutacje genu DMD kodującego białko dystrofinę. U chorych zazwyczaj stwierdza się delecje jednego lub więcej egzonu (60%), duplikacje (5–10%) i mutacje punktowe (30–35%). Dystrofina wraz z kompleksem innych białek łączy włókna aktynowe z błoną komórkową, a także bierze udział w przekazywaniu sygnałów w komórkach. Jej brak powoduje uszkodzenia błony komórkowej i nekrozę komórek mięśniowych. W DMD mutacje powodują przesunięcie ramki odczytu i całkowity brak dystrofiny w mięśniach, natomiast w BMD występuje skrócona wersja dystrofiny, dzięki czemu choroba ma lżejszy przebieg.
Objawy
Choroba ma charakter postępujący, początkowo zajmuje mięśnie szkieletowe, potem także mięsień sercowy – prowadząc do kardiomiopatii. Pierwsze objawy występują w wieku 3–8 lat. Obejmują opóźniony rozwój ruchowy, kaczkowaty chód i kłopoty z bieganiem oraz chodzeniem po schodach. Chorzy przy wstawaniu pomagają sobie rękami (objaw Gowersa). Inne objawy to: pseudohipertrofia mięśni łydek i hiperlordoza lędźwiowa. W wieku 12 lat większość chorych nie jest już w stanie samodzielnie chodzić. Często występuje kardiomiopatia. Średni okres przeżycia wynosi w USA 28 lat (Duchenne’a) i 45 (Beckera), do śmierci dochodzi najczęściej w wyniku niewydolności oddechowej lub niewydolności krążenia. W przypadku dystrofii mięśniowej Beckera objawy występują między 5. a 25. rokiem życia, przebieg choroby jest łagodniejszy, czas życia pacjentów jest dłuższy.
Diagnostyka
- badania genetyczne na obecność mutacji w genie kodującym dystrofinę (także badania prenatalne)
- badania biochemiczne (badanie aktywności kinazy kreatynowej w surowicy)
- biopsja mięśnia (cechy miopatii, brak lub nieprawidłowa dystrofina w badaniu immunocytochemicznym)
- EMG
- EKG
- echo serca
- Spirometria
- Gazometria
Diagnostyka preimplantacyjna
Diagnostyka preimplantacyjna pozwala wykryć mutację jeszcze przed implantacją zarodka w jamie macicy. W przypadku obecności mutacji, można zrezygnować z implantacji zarodka obciążonego tą jednostką chorobową[4].
Leczenie
Jak dotąd nie ma skutecznej terapii leczącej dystrofię mięśniową. Terapia sterydami we wczesnych etapach może opóźniać postęp choroby. Nowoczesne metody rehabilitacji, połączone z zabiegami ortopedycznymi, mogą wydłużyć zdolność do utrzymywania pozycji stojącej. Nie oznacza to jednak utrzymania zdolności samodzielnego chodzenia. Poradnictwo genetyczne powinno obejmować wszystkie rodziny, w których stwierdzono występowanie DMD lub BMD.
Od lat 90. prowadzone są badania nad rozwojem terapii genowej dla DMD i BMD. Badania prowadzone na myszach modelowych mdx pozwoliły na przetestowanie wielu strategii terapeutycznych. Od około 2005 roku możliwe jest wyleczenie myszy mdx z dystrofii mięśniowej. Niestety jakiekolwiek próby przeniesienia terapii genowej na leczenie pacjentów, w tym z zastosowaniem nowoczesnej technologii Crispr/Cas, nie powiodły się jak dotychczas.
Aktualnie prowadzone są testy kliniczne lub przedkliniczne terapii na dystrofię DMD z zastosowaniem metody tzw. exon skipping (modyfikowane oligo lub morfolino oligo), terapie komórkami macierzystymi oraz klasyczna terapia genowa (w tym exon skipping, rekombinacja homologiczna czy wymiana genu).
Przypisy
- ↑ JR Mendell, Z Sahenk, TW Prior. The childhood muscular dystrophies: diseases sharing a common pathogenesis of membrane instability. „J Child Neurol”. 10 (2), s. 150–159, 1995. DOI: 10.1177/088307389501000219. PMID: 7782608.
- ↑ Ellen J. Annexstad, Inger Lund-Petersen, Magnhild Rasmussen, Duchenne muscular dystrophy, „Tidsskrift for Den Norske Laegeforening: Tidsskrift for Praktisk Medicin, Ny Raekke”, 134 (14), 2014, s. 1361–1364, DOI: 10.4045/tidsskr.13.0836, ISSN 0807-7096, PMID: 25096430 [dostęp 2018-02-16].
- ↑
 P. Ferrier, F. Bamatter, D. Klein. Muscular Dystrophy (Duchenne) in a Girl with Turner’s Syndrome. „J Med Genet”. 2 (1), s. 38–46, 1965. DOI: 10.1136/jmg.2.1.38. PMID: 14296923. PMCID: PMC1012803.
P. Ferrier, F. Bamatter, D. Klein. Muscular Dystrophy (Duchenne) in a Girl with Turner’s Syndrome. „J Med Genet”. 2 (1), s. 38–46, 1965. DOI: 10.1136/jmg.2.1.38. PMID: 14296923. PMCID: PMC1012803. - ↑ ESHRE: Guidelines for FISH-based PGD. [dostęp 2021-05-29]. [zarchiwizowane z tego adresu (2012-04-02)].
Linki zewnętrzne
- http://neurologia1.wum.edu.pl/node/115
- MUSCULAR DYSTROPHY, DUCHENNE TYPE; DMD w bazie Online Mendelian Inheritance in Man (ang.)
- MDA Europe
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
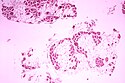
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Histopathology of gastrocnemius muscle from patient who died of pseudohypertrophic muscular dystrophy, Duchenne type. Cross section of muscle shows extensive replacement of muscle fibers by adipose cells.
X-linked Recessive inheritance From http://ghr.nlm.nih.gov/
- Re-creation of entire image in svg format by drsrisenthil