Eliminacja (chemia)
Eliminacja − reakcja chemiczna, w wyniku której z cząsteczki usuwane (eliminowane) są atomy lub grupy atomów, bez jednoczesnego przyłączenia się innych atomów lub grup.
Efektem eliminacji jest powstanie nowego wiązania między atomami pozostającymi w związku po reakcji na skutek:
- utworzenia wiązania π (zwiększenia krotności wiązań)
- cyklizacji cząsteczki
Typowym przykładem eliminacji w chemii organicznej jest oderwanie pary podstawników (np. cząsteczki wodoru H−H, chlorowodoru H−Cl, chloru Cl−Cl, wody H−OH itd.), co prowadzi do utworzenia dodatkowego wiązania π między atomami węgla i zwiększa stopień nienasycenia w cząsteczce. Reakcja eliminacji umożliwia otrzymywanie produktów bardziej nienasyconych. Produktami reakcji eliminacji mogą być alkeny bądź alkiny. W większości przypadków eliminacja biegnie zgodnie z regułą Zajcewa, choć znanych jest wiele przykładów, gdzie głównym produktem reakcji eliminacji jest alken o wiązaniu podwójnym przy mniej podstawionym atomie węgla. Wyjątki te dotyczą zgodnie z regułą Hoffmana zasad posiadających duże zawady steryczne np. tert-butanolan potasu, a także eliminacji w podstawionych cykloalkanach jak na przykład eliminacja mentolu.
Eliminacja może być katalizowana kwasem lub zasadą, a także przebiegać spontanicznie lub pod wpływem czynników środowiskowych (światła, ciepła itp.).
Mechanizm reakcji
Znane są dwa rodzaje mechanizmu, według których eliminacja może przebiegać: E1 − jednocząsteczkowo lub E2 − dwucząsteczkowo.
- Mechanizm E1
Reakcja dwuetapowa. Podczas pierwszego etapu powstaje karbokation w wyniku heterolitycznej dysocjacji wiązania, w drugim etapie zasada odrywa proton od sąsiadującego z karbokationem atomu węgla.
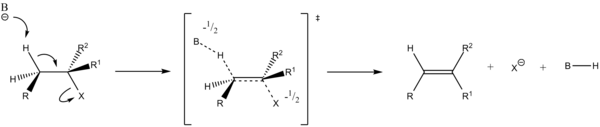
- Mechanizm E2
Reakcja przebiega w jednym etapie, podczas którego zasada odrywa proton i odchodzi grupa opuszczająca.
Kinetyka reakcji
- E1
Etapem determinującym (rds z ang. Rate-determining step) szybkość reakcji (v) eliminacji E1 jest etap pierwszy, w którym powstaje karbokation jako produkt przejściowy. Etap drugi tej reakcji przebiega stosunkowo szybko, gdyż karbokationy są z reguły nietrwałe, dlatego reakcja dąży do utworzenia termodynamicznie trwalszego produktu.
Zgodnie z równaniem reakcji:
- R1R2HC−CR3R4X → R1R2HC−C+R3R4 + X−
eliminacja E1 jest reakcją pierwszego rzędu:
- v = k[R1R2HC−CR3R4X]
- E2
Etapem determinującym (rds) szybkość reakcji (v) eliminacji E2 jest również etap pierwszy. Jednak w eliminacji E2 w etapie determinującym v udział biorą dwie cząsteczki zgodnie z równaniem:
- B + HR1R2C−CR3R4X → B····H····(R1R2)C⎓C(R3R4)····X
dlatego jest to reakcja drugiego rzędu:
- v = k[R1R2HC−CR3R4X] [B]
Warunki reakcji
Reakcja E1 zachodzi głównie dla trzeciorzędowych halogenków alkilowych w roztworach o niskim stężeniu zasady. Z kolei reakcja E2 zachodzi głównie w procesach dehydrohalogenacji (−HX) i wymaga dużego stężenia zasady.
Zobacz też
Bibliografia
- Robert T. Morrison, Robert N. Boyd: Chemia Organiczna. T. 1. Warszawa: Wydawnictwo Naukowe PWN, 1997, s. 555-566. ISBN 83-01-04-166-8.
Media użyte na tej stronie
general E1 elimination eaction