Erytrocyt
| erythrocytus | |
 Czerwone krwinki |
Erytrocyt (gr. erythros czerwony + kytos komórka), krwinka czerwona, czerwone ciałko krwi[1][2] – morfotyczny składnik krwi, którego głównym zadaniem jest przenoszenie tlenu z płuc do pozostałych tkanek organizmu.
Po raz pierwszy erytrocyty zostały zaobserwowane i precyzyjnie opisane jako okrągłe spłaszczone w środku komórki przez Antonie van Leeuwenhoeka w XVII w.[3]
Budowa komórki
Prawidłowy erytrocyt ssaków jest okrągłą[4], dwuwklęsłą w środku komórką o średnicy 6–9 μm[5]. Wyjątkowe wśród ssaków są owalne erytrocyty wielbłądowatych (wielbłądy, lamy, alpaki)[6][4]. Owalny kształt jest charakterystyczny dla płazów, gadów i ptaków[6]. Wielkość u różnych zwierząt jest zmienna. U zwierząt domowych mieści się w zakresie 3–7 μm[6]. U konia, krowy, świni, psa, kota i człowieka ma średnicę 6–7 μm i grubość 2 μm na obrzeżu, u owcy i kozy mają 4–5 μm średnicy[4] (3,2–4,5 według Dellmanna[6]). Inne źródła podają dla człowieka: średnica – 8 μm, grubość w środku do 2 μm i do 2,5 μm na obrzeżu[7]. Średnia objętość krwinki wynosi około 60 μm³[4]. Erytrocyt o średniej średnicy (jaką ma 75% z nich) nazywa się normocytem, krwinki większe od prawidłowych to makrocyty, natomiast mniejsze to mikrocyty[7].
Erytrocyty ptaków posiadają jądra komórkowe, mają kształt eliptycznej, obustronnie wklęsłej soczewki. Dłuższa oś mierzy 9,5–20 μm, krótsza – 5,5–10 μm. W 1 mm³ krwi ptasiej może znajdować się od 1,5 do 5,5 miliona erytrocytów. Im większy ptak, tym większe ma erytrocyty, jednak zarazem ma ich mniej. Przykładowo, wróbel mazurek w mm³ krwi ma blisko 5,2 mln czerwonych krwinek, a kruk – 3,93 mln[8].
U wszystkich ssaków oraz u niektórych płazów ogoniastych[9][10], w przeciwieństwie do pozostałych kręgowców, dojrzałe erytrocyty są komórkami bezjądrzastymi. Można jednak spotkać fragmenty jądra komórkowego lub ciałka Howella-Jolly’ego w niektórych erytrocytach kota i konia[6]. U większości ssaków zwiększona liczba erytrocytów jądrzastych wskazuje na odpowiedź organizmu na anemię (przyspieszone uwalnianie niedojrzałych erytrocytów do układu krążenia) zaburzenia w funkcjonowaniu śledziony lub splenektomię (wycięcie śledziony)[6]. U ssaków w końcowym okresie różnicowania się erytrocytów zanikają w nich również inne organella: mitochondria, aparat Golgiego, centriole.
Funkcje
Mężczyzna ma około 5 mln/mm³[7] erytrocytów w krwi obwodowej, kobieta około 4,5 mln/mm³[7], natomiast noworodek około 7 mln/mm³. Ilość erytrocytów w organizmie człowieka może się zmieniać – zależy to m.in. od miejsca, w którym człowiek się znajduje i ciśnienia, jakie tam panuje, np. w górach może ich być do 8 mln/mm³[7].
Głównym zadaniem erytrocytów jest przenoszenie tlenu z płuc (gdzie z powodu wyższego ciśnienia parcjalnego tlenu w pęcherzykach następuje utlenowanie krwi w krążeniu małym) i dostarczanie go do tkanek obwodowych (również serca i płuc[nota 1]). Dzieje się to dzięki obecności w każdym z nich 30 pg[4] czerwonego barwnika (hemoglobiny), zdolnego do nietrwałego wiązania tlenu (oksyhemoglobina), który w miejscu docelowym oddaje tlen tkankom o niższym jego ciśnieniu parcjalnym. Erytrocyty częściowo również transportują dwutlenek węgla (CO
2), jednak jest on przenoszony głównie przez osocze w postaci jonowej (HCO−
3).
Krwinki czerwone ssaków – z powodu utraty jądra komórkowego – nie dzielą się. Nie mogą pełnić normalnych funkcji komórkowych, nie mają też mechanizmu, który mógłby naprawiać uszkodzenia i po kilku miesiącach użytecznego życia (ok. 120 dni) ulegają zniszczeniu (głównie w śledzionie, rzadziej w wątrobie). Organizm musi zatem nieustannie produkować nowe erytrocyty.
Wytwarzanie
Od urodzenia praktycznie wszystkie krwinki są wytwarzane w szpiku kostnym[11] czerwonym, znajdującym się w istocie gąbczastej, tj. w nasadach kości długich i kościach płaskich. Zachodzi tam proces erytropoezy, w którym erytrocyty powstają z komórek macierzystych erytrocytów (erytroblastów) z szybkością ok. 120 mln[12] na minutę. W życiu płodowym namnażane są również w śledzionie (ok. 3–7 miesiąca życia płodowego).
Choroby związane z erytrocytami
Zaburzenia związane z czerwonymi krwinkami:
- erytrocytopenia – obniżona liczba czerwonych krwinek; występuje w niektórych formach anemii;
- erytrocytoza (lub czerwienica prawdziwa) – zwiększona liczba czerwonych krwinek.
Substytucja krwinek czerwonych
Naukowcy potrafią wyprodukować erytrocyty poza organizmem człowieka z prekursorów komórkowych, takich jak somatyczne komórki macierzyste, embrionalne komórki macierzyste, indukowane pluripotencjalne komórki macierzyste (iPS) oraz z biomateriałów syntetycznych[5].
Produkcja z somatycznych komórek macierzystych daje niskie ryzyko zezłośliwienia i infekcji, jednak ograniczona jest umiejętność do samoodtwarzania, niezgodność tkankowa jest porównywalna jak przy przetaczaniu krwi pobieranej od dawców. Wytwarzanie krwinek tym sposobem na szeroką skalę jest prawie niemożliwe, co wyklucza tę metodę z praktyki w przyszłości[5].
Produkcja z embrionalnych komórek macierzystych oraz z indukowanych pluripotencjalnych komórek macierzystych pozwala produkcję nieograniczonej ilości komórek o różnych fenotypach w układzie AB0 i RhD. Jednak metody pozyskiwania tych komórek macierzystych wywołują kontrowersje na tle moralnym oraz niosą ryzyko transmisji patogenów oraz zezłośliwienia (przy wytwarzaniu iPS używane są wektory zawierających onkogeny). Jedna z metod polega na produkcji erytrocytów z hemangioblastów (otrzymuje się 30–65% dojrzałych erytrocytów) przy użyciu wielu cytokin (takich jak BMP4, VEGF165, czy trombopoetyna). W innej metodzie hoduje się komórki macierzyste ze komórkami stromalnymi, pobranymi z wątrób gryzoni laboratoryjnych. Uzyskane w ten sposób erytrocyty początkowo zawierają hemoglobinę płodową (HbF) i embrionalną, jednak z czasem w hodowli nabierają cech dojrzałej hemoglobiny HbA, charakteryzując się jednocześnie zadowalającym poziomem aktywności dehydrogenazy glukozo-6-fosforanowej[5].
Seifinejad z zespołem zdołał wyindukować komórki pluripotencjalne pnia z fibroblastów skóry osobnika o krwinkach typu Bombay, poprzez zastosowanie ektopowej ekspresji czynników transkrypcyjnych Klf4, Oct4, Sox2 i c-Myc. Fenomen bombajski polega na braku antygenów ABH układu AB0 (w wyniku braku genu H, FUT1, i genu sekrecyjnego, FUT2)[5].
Doshi ze współpracownikami postanowili zastosować strategię biomimetyczną i usiłowali zsyntetyzować cząsteczki podobne do erytrocytów, zbudowane z biokompatybilnego i biodegradowalnego polimeru PLG (polylactic-co-glycolide) inkubowanego w propan-2-olu. Hemoglobinę absorbowano na powierzchni polimeru i łączono krzyżowo z aldehydem glutarowym z następującym rozpuszczaniem rdzenia. Cząsteczki wzmocniono również dodatkowym łańcuchem hemoglobiny w celu zwiększenia pojemności w zakresie przenoszenia tlenu. W efekcie krwinki te charakteryzują się niemal identyczną morfologią, umiejętnością przenoszenia tlenu, rozmiarem, sprężystością i rozciągliwością jak naturalne krwinki czerwone[5].
Uwagi
- ↑ Narządy te oprócz zaopatrywania organizmu w utlenowaną krew same również potrzebują (jak każda tkanka) tlenu.
Przypisy
- ↑ erytrocyty, [w:] Encyklopedia PWN [online] [dostęp 2021-04-06].
- ↑ krwinki czerwone, [w:] Słownik terminów biologicznych PWN [online] [dostęp 2021-04-06].
- ↑ Gerald Messadié: 120 odkryć które zmieniły świat : leksykon. Łódź: Opus, 1995. ISBN 83-7089-028-8. (pol.)
- ↑ a b c d e Tadeusz Krzymowski, Jadwiga Przała: Fizjologia zwierząt : podręcznik dla studentów wydziałów medycyny weterynaryjnej, wydziałów biologii i hodowli zwierząt akademii rolniczych i uniwersytetów : praca zbiorowa. Warszawa: Państwowe Wydawnictwo Rolnicze i Leśne, 2005, s. 222. ISBN 83-09-01792-8.
- ↑ a b c d e f G. Lippi, M. Montagnana, M. Franchini. Ex-vivo red blood cells generation: a step ahead in transfusion medicine?. „Eur J Intern Med”. 22 (1), s. 16-9, Feb 2011. DOI: 10.1016/j.ejim.2010.08.001. PMID: 21238887.
- ↑ a b c d e f Jo Ann Eurell, Brian L. Frappier: Dellmann's textbook of veterinary histology. Wyd. 6. Blackwell Publishing, 2006, s. 62. ISBN 978-0-7817-4148-4. (ang.)
- ↑ a b c d e Wojciech. Sawicki: Histologia. Warszawa: Wydawnictwo Lekarskie PZWL, 2009, s. 203–204. ISBN 978-83-200-4103-3.
- ↑ IX Układ krwionośny. W: Bronisław Ferens i Roman J. Wojtusiak: Ornitologia ogólna. Ptak, jego budowa i życie. Warszawa: Państwowe Wydawnictwo Naukowe, 1960, s. 211–212.
- ↑ W. D. Cohen. The cytomorphic system of anucleate non-mammalian erythrocytes. „Protoplasma”. 113, s. 23, 1982. DOI: 10.1007/BF01283036 (ang.).
- ↑ Wingstrand KG. Non-nucleated erythrocytes in a teleostean fish Maurolicus mülleri (Gmelin). „Zeitschrift Für Zellforschung Und Mikroskopische Anatomie”. 45 (2), s. 195–200, 1956. DOI: 10.1007/BF00338830. PMID: 13402080 (ang.).
- ↑ Erslev A, Gabuzda T: Pathophysiology of blood 2ed. Philadelphia: WB Saunders, 1979, s. 446.
- ↑ Implications of Neocytolysis for Optimal Management of Anaemia in Chronic Kidney Disease
Bibliografia
- Władysław Z. Traczyk, Andrzej Trzebski, Fizjologia człowieka z elementami fizjologii stosowanej i klinicznej, wyd. III, s. 399–408, ISBN 83-200-3020-X.
Zobacz też
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Faustus1983, Licencja: CC BY-SA 4.0
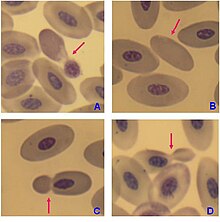
Cytological abnormalities in peripheral blood erythrocytes of penguins Pygoscelis papua. A, C, D – “budding” erythrocytes; B – enucleated erythrocyte. Blood samples were collected by Assist. Prof. Dr. Vladimir Bezrukov, Taras Shevchenko National University of Kyiv, in 2003-2004 during VIII Ukrainian Antarctic expedition (Gentoo Penguin Colony, Petermann island, 65°10'S, 64°10'W). Mature erythrocytes of birds have a nucleus, however in the blood of adult females of Pygoscelis papua enucleated red blood cells have been observed (with very low frequency).
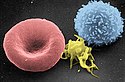
Od lewej do prawej: erytrocyt, trombocyt, leukocyt
Wpływ presji osmotycznej na krwinkę czerwoną.