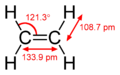Eten
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C2H4 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 28,05 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | bezbarwny gaz o słodkim zapachu[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||

Eten, etylen, C2H4 – organiczny związek chemiczny, najprostszy możliwy alken (węglowodór nienasycony).
Właściwości
Eten jest gazem bezbarwnym, o słodkawym zapachu. Jest substancją łatwopalną. Rozpuszcza się bardzo dobrze w rozpuszczalnikach niepolarnych np. arenach i alkanach.
Budowa
Jest to cząsteczka płaska i symetryczna, a kąty pomiędzy wiązaniami (H-C-H) wynoszą 120°. Długości wiązania w tej cząsteczce wynoszą odpowiednio:
- pomiędzy atomem węgla a atomami wodoru 110 pm;
- pomiędzy atomami węgla 134 pm;
W wyniku hybrydyzacji orbitali (sp2) w obu atomach węgla, pomiędzy nimi występuje jedno wiązanie π i jedno wiązanie σ. Ulega reakcjom addycji, utlenienia i polimeryzacji.
W mieszaninie z powietrzem jest wybuchowy w granicach stężeń 2,75–28,6%, oraz podczas ogrzewania pod zwiększonym ciśnieniem.
Występowanie, otrzymywanie i zastosowanie
W stanie naturalnym występuje w niewielkich (zmiennych) ilościach w gazie ziemnym. Otrzymywany jest na skalę techniczną podczas termicznego rozkładu węglowodorów gazowych i ciekłych (piroliza etenowo-propenowa), z gazowych produktów procesów rafinacji ropy naftowej (kraking termiczny i katalityczny, hydrokraking, reforming) i z gazów koksowniczych.
Niewielkie ilości etenu do celów laboratoryjnych można otrzymać w wyniku odwodnienia etanolu przez wkraplanie go do gorącego kwasu siarkowego lub podczas ogrzewania etanolu z tlenkiem glinu:
- C2H5OH → C2H4↑ + H2O
Można też otrzymać poprzez ogrzewanie folii polietylenowej (reakcja depolimeryzacji):
- -[-CH2-CH2-]-n → n C2H4↑
Eten jest jednym z podstawowych surowców przemysłu petrochemicznego. Stosowany jest do produkcji polietylenu i wielu kopolimerów, etylobenzenu (do produkcji styrenu), tlenku etylenu, chloropochodnych (chlorek winylu, dichloroetan), etanolu i wyższych alkoholi alifatycznych.
Etylen w biochemii
Etylen jest hormonem roślinnym, stymulującym opadanie liści, dojrzewanie owoców, starzenie się roślin. Wydzielany jest przez praktycznie wszystkie części rośliny[5].
Biosynteza
Biosynteza etylenu przebiega w kilku etapach. Substratem jest metionina, która jest przekształcana w S-adenozylometioninę (SAM) przez enzym o nazwie syntaza SAM. Następnie SAM jest przekształcana w kwas 1-aminocyklopropano-1-karboksylowy (ACC) przez syntazę ACC (ACS), natomiast metionina jest regenerowana w cyklu Yanga (patrz schemat obok). Ostatnim etapem jest konwersja ACC do etylenu przez oksydazę ACC (ACO), gdzie ACC jest utleniany przy udziale oksydazy ACC do etylenu oraz dwutlenku węgla i cyjanowodoru[6].
Zastosowanie
W przechowalniach owoców skuteczne usuwanie etylenu wydzielanego przez owoce zapobiega ich przedwczesnemu dojrzewaniu. Natomiast przed sprzedażą owoce poddaje się działaniu etylenu w celu szybkiego doprowadzenia ich do stanu dojrzałości. Takiemu zabiegowi standardowo poddaje się banany, które zbierane są zielone, w stadium dojrzałości zbiorczej i po dotarciu na miejsce przeznaczenia dla uzyskania jednolitych jakościowo owoców poddane są zabiegowi gazowania etylenem przez okres 4-7 dni[7]. Przedwczesnemu dojrzewaniu zapobiega się blokując działanie etylenu za pomocą 1-Metylocyklopropenu.
Potrójna odpowiedź u roślin
Etylen jest odpowiedzialny za tzw. potrójną odpowiedź u roślin. Gdy nasiono kiełkuje i napotyka przeszkodę, musi wykonać manewr, aby ją ominąć. Etylen stymuluje grubienie łodygi, zmniejszenie elongacji i wykrzywienie się rośliny, tak by ta mogła przedostać się na powierzchnię.
Mutacje
Występuje kilka rodzajów mutacji roślin związanych z etylenem:
- ein – roślina nie ma receptorów etylenu
- eto – roślina produkuje za dużo etylenu, ale reaguje na podawane przez człowieka inhibitory
- ctr – nie reagują na inhibitory (ponieważ nie występuje u nich kinaza, będąca normalnie negatywnym regulatorem ekspresji) i dlatego przeprowadzają potrójną odpowiedź, nawet w powietrzu.
Przypisy
- ↑ a b c d e f g h Eten. The Chemical Database. Wydział Chemii Uniwersytetu w Akronie. [dostęp 2012-08-08]. (ang.).[niewiarygodne źródło?]
- ↑ a b c Ethylene, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2012-08-08] (ang.).
- ↑ a b Etylen (nr 00489) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski.
- ↑ a b Eten (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2015-04-10].
- ↑ S. F. Yang, N. E. Hoffman. Ethylene biosynthesis and its regulation in higher plants. „Ann. Rev. Plant Physiol.”. 35, s. 155–189, 1984. DOI: 10.1146/annurev.pp.35.060184.001103.
- ↑ Fizjologia roślin. Jan Kopcewicz, Stanisław Lewak (red.). Warszawa: Wydawnictwo Naukowe PWN, 2005. ISBN 83-01-14549-8.
- ↑ Edward Lange, Waldemar Ostrowski: Przechowalnictwo owoców. Warszawa: PWRiL, 2002, s. 301. ISBN 83-09-01494-5.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for gas bottles
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Structural formula of the ethylene (ethene) molecule, C2H4. The molecule belongs to the D2hpoint group.
Structural information (determined by microwave spectroscopy) from CRC Handbook, 88th edition.The hazard symbol for flammable/highly flammable substances according to directive 67/548/EWG by the European Chemicals Bureau.
Ball-and-stick model of the ethylene (ethene) molecule, C2H4.
Structural information (determined by microwave spectroscopy) from CRC Handbook, 88th edition.
Image generated in Accelrys DS Visualizer.Autor: Walter J. Pilsak, Waldsassen, Licencja: CC-BY-SA-3.0
Tomaten im Treibhaus