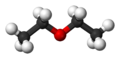
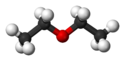
Eter dietylowy
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C4H10O | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | C | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa molowa | 74,12 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | bezbarwna, palna, lotna ciecz[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Legalność w Polsce | |||||||||||||||||||||||||||||||||||||||||||||||||||||
Eter dietylowy (pot. eter etylowy[a], eter[13]) – organiczny związek chemiczny z grupy eterów, zbudowany z dwóch grup etylowych przyłączonych do atomu tlenu. Ma właściwości narkotyczne, nasenne i znieczulające. Nałogowe wąchanie lub spożywanie eteru nosi nazwę eteromanii.
Otrzymywanie
Eter dietylowy otrzymuje się w wyniku dehydratacji alkoholu etylowego (działając na niego stężonym kwasem siarkowym w temperaturze 140 °C). W przemyśle otrzymywany jest w wyniku dehydratacji par alkoholu etylowego przepuszczanych nad Al
2O
3 lub zeolitami.
Właściwości fizykochemiczne
Eter dietylowy jest bezbarwną, lotną, skrajnie łatwopalną cieczą[14]. Z powietrzem (i tlenem) tworzy mieszaninę wybuchową. Jego pary są cięższe od powietrza (gęstość par eteru jest 2,56 raza większa od gęstości powietrza[4]), co powoduje, że „pełzają” po stole laboratoryjnym, unosząc się z otwartej butelki.
Zastosowanie
- rozpuszczalnik – w ekstrakcji oraz w wielu syntezach organicznych (szczególnie w reakcji Grignarda)
- w preparatyce farmaceutycznej – do sporządzania leków galenowych, m.in. kolodium[15]
- może być stosowany do znieczulenia ogólnego (narkozy)[16], choć w praktyce jest wypierany przez inne leki; blokuje kanały potasowe[17]
Zagrożenia
Eter dietylowy jest substancją bardzo lotną i niezwykle łatwopalną (temperatura zapłonu −45 °C[12]). Z powietrzem atmosferycznym tworzy mieszaninę wybuchową już w niskich temperaturach. Pary eteru jako cięższe od powietrza mają tendencję do gromadzenia się przy ziemi i mogą przesuwać się po niej na dość znaczne odległości. Zapłon mieszaniny powietrzno-eterowej może nastąpić nie tylko od iskry czy płomienia, lecz nawet w wyniku kontaktu z gorącą powierzchnią, np. płytą grzejną lub gorącym trójnogiem[13].
Eter dietylowy (podobnie jak inne etery) ma skłonność do tworzenia wybuchowych, wysokowrzących nadtlenków w wyniku działania światła i kontaktu z powietrzem. Oddestylowanie eteru zawierającego nadtlenki prowadzi do ich zatężenia i może spowodować eksplozję. Dlatego przed przystąpieniem do destylacji eteru należy wykonać test na obecność nadtlenków, a w razie stwierdzenia ich obecności należy rozłożyć je za pomocą środka redukującego[13].
W celu zmniejszenia ryzyka wytworzenia nadtlenków do eteru występującego w handlu bywają dodawane stabilizatory, np. butylowany hydroksytoluen jako przeciwutleniacz. Wodę i nadtlenki usuwa się z eteru poprzez destylację znad sodu i benzofenonu albo przepuszczając eter przez kolumnę wypełnioną aktywowanym glinem[18].
Zobacz też
- lista czynników chłodniczych
- eteromania
- anodyna
Uwagi
- ↑ Z formalnego punktu widzenia eter etylowy to ogólna nazwa każdego eteru, w którym występuje jedna grupa etylowa (C
2H
5−). W praktyce laboratoryjnej i przemysłowej nazwa ta odnosi się do eteru dietylowego.
Przypisy
- ↑ a b Henri A. Favre, Warren H. Powell, Nomenclature of Organic Chemistry. IUPAC Recommendations and Preferred Names 2013 (Blue Book), Royal Society of Chemistry, International Union of Pure and Applied Chemistry, 2014, s. 703, DOI: 10.1039/9781849733069, ISBN 978-0-85404-182-4 (ang.).
- ↑ Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 124, ISBN 83-7183-240-0.
- ↑ a b c d Lide 2009 ↓, s. 3-168.
- ↑ a b c d Eter Dietylowy (nr 309966) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2020-06-23]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- ↑ a b Lide 2009 ↓, s. 6-58.
- ↑ a b Lide 2009 ↓, s. 6-177.
- ↑ Lide 2009 ↓, s. 6-128.
- ↑ Lide 2009 ↓, s. 9-54.
- ↑ a b Eter dietylowy (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2015-04-10].
- ↑ Eter dietylowy (nr 309966) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Stanów Zjednoczonych. [dostęp 2012-07-12]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b c Lide 2009 ↓, s. 15-16.
- ↑ a b c Arthur I. Vogel, Preparatyka organiczna, wyd. 2, Warszawa: Wydawnictwa Naukowo-Techniczne, 1984, s. 223.
- ↑ etylowy eter, [w:] Encyklopedia techniki. Chemia, Władysław Gajewski (red.), Warszawa: Wydawnictwa Naukowo-Techniczne, 1965, s. 203, OCLC 33835352.
- ↑ Farmakopea Polska XII 2020 – monografia szczegółowa t.1 > Aether – Eter dietylowy.
- ↑ Farmakopea Polska XII 2020 – monografia szczegółowa > Aether anaestheticus – Eter dietylowy do narkozy. [Obecnie obowiązujące XII wydanie FP wymienia nadal tę monografię (s. 2113), więc oficjalnie lek istnie nadal.]
- ↑ Tadeusz Krzymowski, Jadwiga Przała: Fizjologia zwierząt. Podręcznik dla studentów wydziałów medycyny weterynaryjnej, wydziałów biologii i hodowli zwierząt akademii rolniczych i uniwersytetów. Warszawa: Państwowe Wydawnictwo Rolnicze i Leśne, 2005, s. 27. ISBN 83-09-01792-8.
- ↑ W.L.F. Armarego, C.L.L. Chai, Purification of laboratory chemicals, 2003, ISBN 978-0-7506-7571-0.
Bibliografia
- David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, ISBN 978-1-4200-9084-0 (ang.).
- Słownik chemiczny. Wyd. VII. Warszawa: Wiedza Powszechna, 1995.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.The hazard symbol for flammable/highly flammable substances according to directive 67/548/EWG by the European Chemicals Bureau.
(c) Wolfmankurd z angielskiej Wikipedii, CC-BY-SA-3.0
Diethyl ether chemical structure