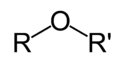Etery
| Ten artykuł od 2021-01 wymaga zweryfikowania podanych informacji. |
Etery – organiczne związki chemiczne, w których występują wiązania C-O-C, przy czym żaden z atomów węgla nie jest związany z więcej niż jednym atomem tlenu.
Właściwości
Wiązanie C-O-C jest dość trwałe. Rozkłada się dopiero pod wpływem działania silnych kwasów lub zasad w podwyższonej temperaturze, dzięki czemu etery są dość trwałymi i niezbyt reaktywnymi związkami. W najprostszym przypadku etery składają się z dwóch grup organicznych (R, R') połączonych atomem tlenu (R-O-R'), są jednak także znane polietery, w których występuje więcej niż jedno wiązanie C-O-C. Niektóre cykliczne polietery znane są pod nazwą eterów koronowych.
Proste etery zawierające tylko grupy alkilowe są bardzo słabo polarnymi związkami (nieco bardziej polarnymi niż alkeny, jednak mniej niż alkohole i estry). Rozpuszczalność eterów w wodzie jest podobna do rozpuszczalności alkoholi o tej samej masie cząsteczkowej (np. eter dietylowy i butan-1-ol ok. 8g na 100g wody).
Eter dimetylowy CH3OCH3 i etylometylowy CH3OC2H5 są gazami. Począwszy od eteru dietylowego CH3CH2OCH2CH3 etery alkilowe są cieczami. Część z nich ma działanie narkotyczne, np. niegdyś powszechnie stosowany w medycynie eter dietylowy.
Etery tworzą kompleksy ze związkami wykazującymi deficyt elektronów (kwasami Lewisa), np. z BF3 lub ze związkami Grignarda.
Synteza
Najtańszą metodą otrzymywania eterów jest reakcja dehydratacji alkoholi, w praktyce jest ona ograniczona do syntezy eteru dietylowego:
- 2 C2H5OH → C2H5OC2H5 + H2O (wiązana przez H2SO4)
lub reakcji alkoholi z chloro- i bromoalkanami
- ROH + Cl-R' → ROR' + HCl
Metodę syntezy niesymetrycznych eterów z halogenków alkilowych i alkoholanów opracował A. Williamson. Metoda ta znana jest obecnie jako synteza Williamsona:
Zastosowanie
Etery dialkilowe (najczęściej eter dietylowy) są stosowane jako mało polarne rozpuszczalniki, np. do otrzymywania związków Grignarda. Inne często stosowane etery to cykliczny tetrahydrofuran (THF), wykorzystywany jako rozpuszczalnik organiczny o umiarkowanej polarności oraz bardziej polarny cykliczny dieter, dioksan.
Eter dietylowy jest najstarszym środkiem do narkozy, używanym od roku 1846. Wtedy to amerykański dentysta William Morton w Charlton w Massachusetts wypróbował go do znieczulenia przed ekstrakcją zęba, a następnie podczas publicznego zabiegu chirurgicznego. W 4 miesiące później pierwszej takiej operacji na ziemiach polskich dokonano w Krakowie.
Nadtlenki eterów
Etery podatne są na utlenianie tlenem. W wyniku reakcji tworzą się wodoronadtlenki eterów (następuje rodnikowa insercja cząsteczki tlenu, z rozerwaniem wiązania C-H przy węglu połączonym z tlenem). Nadtlenki są silnymi utleniaczami, odbarwiają wodę bromową, są inicjatorami reakcji wolnorodnikowych oraz są wybuchowe. Etery pozostawione w kontakcie z powietrzem mogą zawierać spore ilości nadtlenków. Są one wyżej wrzące od eterów i stanowią poważne zagrożenie przy ich destylacji (nigdy nie destyluje się eterów do końca).
Inne (zwyczajowe) użycie nazwy eter w chemii
Pierwotnie terminem eter określano wszelkie substancje charakteryzujące się względną łatwością przeprowadzenia w stan gazowy. Cecha ta jest właściwa także dla substancji chemicznie nie będących eterami:
- Eter naftowy – jedna z lżejszych frakcji ropy naftowej zawierająca głównie n-pentan i n-heksan oraz ich izomery. Temperatura wrzenia wynosi około 40 °C i jest zależna od sposobu otrzymania. Nazwa jest stosowana do dziś.
- Eter octowy – archaizm oznaczający octan etylu. Nazwa występuje w XIX-wiecznej literaturze chemicznej, obecnie stosowana rzadko, jako nazwa zwyczajowa. Temperatura wrzenia 77 °C.
- Olejki eteryczne – mieszaniny otrzymane przez destylację surowców roślinnych z parą wodną. Są to zwykle najbardziej lotne substancje organiczne zawarte w roślinie.