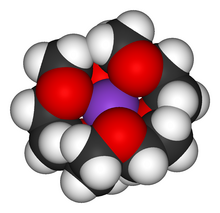
Etery koronowe
Etery koronowe, korony – makrocykliczne związki organiczne pochodzenia syntetycznego. Są to cykliczne polietery o regularnej budowie wykazujące właściwości jonoforetyczne. Etery koronowe są zdolne do selektywnego tworzenia trwałych kompleksów (koronatów) z kationami, np. metali alkalicznych. Pierwszy eter koronowy, 18-korona-6, został otrzymany przez Charlesa Pedersena w 1967 roku[1]. Badania nad eterami koronowymi o trójwymiarowymi strukturach (kryptandami, sferandami, karcerandami) prowadzili Donald Cram i Jean-Marie Lehn, którzy wraz z Pedersenem otrzymali Nagrodę Nobla w dziedzinie chemii w roku 1987 za „wkład w badania cząsteczek, które dzięki swej strukturze oddziałują w sposób wysoce selektywny z innymi cząsteczkami”[2][3].
Własności
Etery koronowe są szczególnie interesującą klasą związków chemicznych z czterech powodów:
- posiadają one unikalną cechę rozpuszczalności w niemal wszystkich znanych rozpuszczalnikach, dzięki zjawisku „zwijania się” i „rozwijania”,
- są doskonałymi ligandami dla wielu jonów – łączą się one z jonami stosunkowo słabymi oddziaływaniami jon-dipol, które jednak po zsumowaniu wielu takich oddziaływań dają trwały kompleks,
- są bardzo selektywnymi ligandami – zmieniając rozmiar i topologię ich układów cyklicznych, można otrzymywać związki, które wiążą ściśle określone jony, np. wyłącznie K+
lub wyłącznie Mg2+
, ze ściśle określoną „siłą”, - w przypadku kryptandów i sferandów, skompleksowany jon staje się „niewidzialny” dla innych cząsteczek, gdyż jest otoczony ze wszystkich stron przez ligand.
Własności te są szeroko wykorzystywane. Stosuje się je do:
- przyspieszania reakcji chemicznych z udziałem jonów – ich aktywność katalityczna jest często zbliżona do aktywności dużo bardziej złożonych chemicznie enzymów,
- selektywnego „transportu” jonów z fazy wodnej do organicznej w trakcie np. prowadzenia reakcji chemicznych „na granicy” faz (zobacz też: Kataliza przeniesienia międzyfazowego),
- do „ukrywania” określonych jonów w środowisku reakcji, których obecność powodowałaby nieprawidłowy przebieg tych reakcji (tzw. maskowanie jonów),
- do oczyszczania wody z toksycznych jonów metali ciężkich,
- do modelowania zjawisk selektywnego transportu jonów przez błony komórkowe.
Otrzymywanie
Etery koronowe otrzymuje się zwykle poprzez typowe reakcje eteryfikacji, wychodząc z odpowiednich chlorków i alkoholi. Ich otrzymywanie wymaga prowadzenia reakcji w dużych rozcieńczeniach, gdyż zbyt duże stężenia substratów prowadzą do otrzymywania zwykłych, liniowych polieterów.
Nazewnictwo eterów koronowych
Związki te, zależnie od ich budowy dzieli się na:
- koronandy – w których występuje układ monocykliczny,
- kryptandy – w których występuje układ bicykliczny,
- sferandy – które posiadają układ mono- lub bicykliczny oraz ugrupowania usztywniające całą strukturę.
Etery ściśle cykliczne
Nazwy tworzy się przez podanie liczebnika określającego wszystkie atomy wchodzące w skład makrocyklicznego pierścienia, następnie oddzielona myślnikami nazwa „korona” (ang. „crown”), a następnie liczbę atomów tlenu w pierścieniu makrocyklicznym. Jeśli w cząsteczce eteru koronowego fragmenty etylenowe −CH
2CH
2− są fragmentami pierścienia benzenowego lub cykloheksanowego podaje się odpowiednio w przed nazwą przedrostek „benzo” lub „cykloheksylo”, jeśli jest więcej takich pierścieni dodaje się odpowiedni liczebnik, np. dibenzo-18-korona-6, tricykloheksylo-21-korona-7.
Etery mieszane
Do eterów koronowych zalicza się też czasami układy otwarte i półcykliczne, gdyż zachowują się one często podobnie do typowych eterów koronowych. Są to:
- etery lariatowe,
- semikryptandy,
- semisferandy.
Nazewnictwo kompleksów z udziałem eterów koronowych
| Nazwa liganda | Nazwa kompleksu |
|---|---|
| koronand | koronat |
| kryptand | kryptat |
| sferand | sferat |
| kawitand | kawitat |
| karcerand | karcerat |
Zobacz też
- chemia supramolekularna
- podandy
Przypisy
- ↑ C.J. Pedersen. Cyclic polyethers and their complexes with metal salts. „J. Am. Chem. Soc.”. 89, s. 7017–7036, 1967. DOI: 10.1021/ja01002a035. (ang.).
- ↑ The Nobel Prize in Chemistry 1987. Nobelprize.org. [dostęp 2011-01-16]. (ang.).
- ↑ C.J. Pedersen. The discovery of crown ether (Noble Lecture). „Angew. Chem. Int. Ed. Eng.”. 27, s. 1021–1027, 1988. DOI: 10.1002/anie.198810211. (ang.).; bezpłatna wersja PDF z Nobelprize.org.
Bibliografia
- Grzegorz Schroeder, Chemia supramolekularna, Skrypt wydany przez Wydział Chemii UAM w Poznaniu (dostęp na stronie Wielkopolskiej Biblioteki Cyfrowej).
- THE DISCOVERY OF CROWN ETHERS C.J. Pedersen. nobelprize.org. [zarchiwizowane z tego adresu (2017-08-08)].
- G.W. Gokel: Encyclopedia of Supramolecular Chemistry: Crown Ethers. Boca Raton: CRC Pres Taylor & Francis Group, 2004, s. 326–333. ISBN 0-8247-4723-2.
Media użyte na tej stronie
Przykłady eterów koronowych (część pierwsza)
Etery koronowe - kompleks z jonem potasu
Przykłady eterów koronowych (część druga)
Synteza korandu
Crown ether coordinating a potassium ion