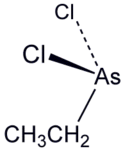Etylodichloroarsyna
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||
| Wzór sumaryczny | C2H5AsCl2 | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | EtAsCl2 | ||||||||||||||||||||||||||||
| Masa molowa | 174,89 g/mol | ||||||||||||||||||||||||||||
| Wygląd | bezbarwna, gęsta, oleista ciecz o gryzącym zapachu czosnku lub owocowym[1][2] | ||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||
Etylodichloroarsyna – arsenoorganiczny związek chemiczny z grupy arsyn, duszący[8] i parzący[1] bojowy środek trujący zaliczany także do sternitów[9]. Wykazuje również, podobnie jak i inne arsyny, działanie łzawiące. Jest środkiem nietrwałym, szybko działającym i łatwym do odkażania[1][8]. Ma właściwości fizykochemiczne zbliżone do metylodichloroarsyny i nieco silniejsze właściwości toksyczne[5][10].
Otrzymywanie
Etylodichloroarsynę otrzymuje się przez alkilowanie (ściślej: etylowanie) trichlorku arsenu. Np. etylodichloroarsyna powstaje w reakcji z tetraetyloołowiem (w temperaturze około 100 °C, aby nie dopuścić do powstania dietylochloroarsyny):
- Pb(C
2H
5)
4 + 4AsCl
3 → 4C
2H
5AsCl
2 + PbCl
4
Otrzymana mieszanina jest następnie destylowana pod zmniejszonym ciśnieniem, co pozwala uzyskać produkt o czystości ok. 95%. Do dalszego oczyszczania można zastosować destylację frakcyjną[11].
Innym, czynnikiem stosowanym do etylowania trichlorku arsenu jest dietylortęć, przy czym reakcja ma gwałtowny przebieg[12]:
- Hg(C
2H
5)
2 + AsCl
3 → C
2H
5AsCl
2 + C
2H
5HgCl
Reakcja AsCl
3 ze związkiem Grignarda, bromkiem etylomagnezu (C
2H
5MgBr), daje etylodichloroarsynę wraz z dietylochloroarsyną i kwasem podarsenawym (H
3AsO
2). Etylodichloroarsyna powstaje także w reakcji etyloarsyny (C
2H
5AsH
2) z chlorkiem rtęci, cyny, fosforu, arsenu lub antymonu[12].
Właściwości
Etylodichloroarsyna to gęsta, ruchliwa, oleista ciecz o zapachu czosnku, wyczuwalnym od stężenia ok. 0,14 ppm[13], dobrze rozpuszczalna w rozpuszczalnikach organicznych. Łatwo utlenia się, np. tlenem z powietrza[1] lub pod wpływem nadmanganianu potasu, dając mniej toksyczny związek, co może być przydatne w jej unieszkodliwianiu[9]. W wodzie hydrolizuje dając kwas chlorowodorowy i tlenek etyloarsyny, związek także toksyczny i parzący o mdłym zapachu czosnku[6][9][14]. Alkalia przyśpieszają hydrolizę[5].
| Lotność (mg/m³) | Temperatura (°C) | Źródło |
|---|---|---|
| 6500 | 0 | [2] |
| 20 000 | 20 | [1][2][6] |
| 27 200 | 25 | [2] |
Produkt techniczny jest brunatną cieczą i, w dużym rozcieńczeniu, zapachu owocowym[1][6]. Stosowany może być w postaci par i aerozoli w bombach lotniczych, minach, pociskach artyleryjskich oraz poprzez rozpylanie z samolotów[14].
Etylodichloroarsynę można ilościowo oznaczyć, podobnie jak metylodichloroarsynę, poprzez ogrzewanie jej z wodą (hydroliza), a następnie zobojętnienie wytworzonego w ten sposób kwasu solnego wobec lakmusu i miareczkowanie mianowanym roztworem jodu w obecności skrobi[5]:
- C
2H
5AsO + I
2 + 2H
2O → C
2H
5AsO(OH)
2 + 2HI
Odróżnienie metylo- i etylodichloroarsyny, ze względu na bardzo podobne właściwości i budowę, bywa trudne. Można to zrobić za pomocą roztworu azotanu rtęci. Etylodichloroarsyna daje z tym roztworem biały osad, ciemniejący po chwili, natomiast metylodichloroarsyna – osad ciemnoszary[14].
Zagrożenia
Z powodu natychmiastowego działania parzącego i mniejszej trwałości, etylodichloroarsyna uważana jest za środek bardziej skuteczny od iperytu siarkowego. Działa parząco na skórę przy gęstości skażenia 0,1–1,0 mg/cm²[1][6], przy 2 g/cm² tworzą się pęcherze[1], zazwyczaj w ciągu 2 do 4 godzin[15]. Pary są drażniące dla oczu, a kontakt ciekłej etylodichloroarsyny powoduje ich ciężkie uszkodzenie. Absorpcja cieczy lub par przez skórę powoduje zatrucie systemowe i może prowadzić do śmierci[2]. Grupa etyloarsenowa może powodować uszkodzenia szpiku kostnego oraz układów trawiennego i hormonalnego[15].
Inhalacja par powoduje uporczywe kichanie, pieczenie w nosie i gardle, podrażnienie górnych i dolnych dróg oddechowych, a także wymioty. Duże stężenia prowadzą do obrzęku płuc i paraliżu kończyn, mogące skutkować śmiercią[1][9]. Uszkodzenia płuc są trwałe i mogą przyczyniać się do łatwiejszego rozwoju infekcji i chorób nowotworowych[15]. Etylodichloroarsyna jest drażniąca przy stężeniu 1,5 mg/m³[6].
Pierwsza pomoc
W przypadku skażenia skóry lub oczu należy przemywać je dużą ilością wody lub roztworem izotonicznym soli kuchennej; można stosować 0,5% roztwór podchlorynu. W przypadku inhalacji podawać czysty tlen o wilgotności 100%[16]. Nie należy stosować ługów, które, mimo łatwego reagowania z etylodichloroarsyną, wytwarzają toksyczny i parzący tlenek etyloarsyny[14].
Historia
Środek ten został otrzymany w 1881 roku przez W. La Coste[1][17]. Przez Niemcy został wprowadzony pod koniec I wojny światowej – w marcu 1918 roku[6] – jako lotny środek mający być szybciej i krócej działającym od fosgenu i iperytu siarkowego, i jednocześnie którego skutki miały trwać dłużej od fenylodichloroarsyny[2]. Była trzecim i ostatnim związkiem arsenowym wprowadzonym przez Niemcy pomiędzy 1917 a 1918 rokiem[15]. Użyty był jednak niewiele razy prawdopodobnie z powodu wykorzystywanego z powodzeniem w tamtych czasach iperytu siarkowego[18]. Stosowany był także w mieszaninie z błękitnym krzyżem[19].
Przypisy
- ↑ a b c d e f g h i j Jerzy Mazur, Etylodichloroarsyna, [w:] 1000 słów o chemii i broni chemicznej, Zygfryd Witkiewicz (red.), Warszawa: Wydawnictwo Ministerstwa Obrony Narodowej, 1987, s. 86–87, ISBN 83-11-07396-1, OCLC 19360683.
- ↑ a b c d e f g h i j k Blister Agents, [w:] Steven L. Hoenig, Compendium of Chemical Warfare Agents, New York: Springer, 2007, s. 5–6, ISBN 978-0-387-34626-7 (ang.).
- ↑ a b Dichloroethylarsine, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 570114 [dostęp 2011-02-25] (niem. • ang.).
- ↑ a b Physical Constants of Inorganic Compounds, [w:] David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, ISBN 978-1-4200-9084-0 (ang.).
- ↑ a b c d e f Związki arsenoorganiczne, [w:] Aleksandra Stachlewska-Wróblowa, Analiza skażeń chemicznych, wyd. 2, Warszawa: Wydawnictwo Ministerstwa Obrony Narodowej, 1985, s. 220.
- ↑ a b c d e f g Ethyl dichloroarsine, [w:] Chemical Warfare Agents. Toxicology and Treatment, Timothy C. Marrs (red.), Robert L. Maynard (red.), Frederick R. Sidell (red.), wyd. 2, John Wiley & Sons, 2007, s. 682, ISBN 978-0-470-01359-5 (ang.).
- ↑ Arsenic compounds, with the exception of those specified elsewhere in this Annex (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2015-03-28].
- ↑ a b Etylodichloroarsyna, [w:] Eric Croddy, Clarisa Perez-Armendariz, John Hart, Broń chemiczna i biologiczna, Warszawa: Wydawnictwa Naukowo-Techniczne, 2003, s. 133, ISBN 83-204-2817-3.
- ↑ a b c d Etylodichloroarsyna, [w:] Stefan Stanisław Korolec, Chemiczne środki bojowe, Warszawa: Wydawnictwo Szkoły Gazowej, 1928, s. 88.
- ↑ Jerzy Mazur, Metylodichloroarsyna, [w:] 1000 słów o chemii i broni chemicznej, Zygfryd Witkiewicz (red.), Warszawa: Wydawnictwo Ministerstwa Obrony Narodowej, 1987, s. 158, ISBN 83-11-07396-1, OCLC 19360683.
- ↑ Preparations of blister agents, [w:] Jared Ledgard, A Laboratory History of Chemical Agents, 2006, s. 120, ISBN 978-0-615-13645-5 [dostęp 2011-02-26] (ang.).
- ↑ a b A Text-Book of Inorganic Chemistry, J. Newton Friend (red.), t. 11 Organometallic Compounds, cz. 2 Derivatives of Arsenic, London: Charles Griffin & Company, 1930, s. 22 [dostęp 2011-02-26] (ang.).
- ↑ Arsenic Agents C04-A, [w:] D. Hank Ellison, Handbook of Chemical and Biological Warfare Agents, wyd. 2, Boca Raton: CRC Press, 2008, s. 200–201, ISBN 978-0-8493-1434-6 (ang.).
- ↑ a b c d Etylodwuchloroarsyna i metylodwuchloroarsyna, [w:] Ministerstwo Obrony Narodowej, Bojowe środki chemiczne. Podręcznik, wyd. 2, Wydawnictwo Ministerstwa Obrony Narodowej, 1953, s. 52–53.
- ↑ a b c d e f Swaran J.S. Flora, Govinder Flora, Geetu Saxena, Arsenicals: Toxicity, their Use as Chemical Warfare Agents, and Possible Remedial Measures, [w:] Handbook of Toxicology of Chemical Warfare Agents, Ramesh C. Gupta (red.), wyd. 1, Elsevier, 2009, s. 116–117, ISBN 978-0-12-374484-5.
- ↑ Methyldichloroarsine, NorthShore University HealthSystem [dostęp 2011-02-26].
- ↑ W. La Coste, Ueber Benzarsinsäuren und deren Derivate, „Liebigs Annalen”, 208 (1–2), 1881, s. 1–16, DOI: 10.1002/jlac.18812080102 (niem.).
- ↑ Robert Noyes, Chemical Weapons Destruction and Explosive Waste/Unexploded Ordnance Remediation, Noyes Publication, 1996, s. 5, ISBN 0-8155-1406-9.
- ↑ Jules Bebie, Manual of Explosives, Military Pyrotechnics and Chemical Warfare Agents. Composition, Properties, Uses, New York: The Macmillan Company, 1943.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.structure of EtAsCl2, an organoarsenic cmpd