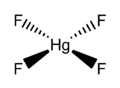
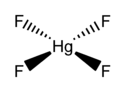
Fluorek rtęci(IV)
| Ten artykuł od 2017-04 zawiera treści, przy których brakuje odnośników do źródeł. |
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| Ogólne informacje | |||||||||||||||
| Wzór sumaryczny | HgF 4 | ||||||||||||||
| Masa molowa | 276,58 g/mol | ||||||||||||||
| |||||||||||||||
| Podobne związki | |||||||||||||||
| Podobne związki | tetrafluorek siarki, fluorek uranu(IV) | ||||||||||||||
Fluorek rtęci(IV) (tetrafluorek rtęci), HgF
4 – nieorganiczny związek chemiczny z grupy fluorków, sól kwasu fluorowodorowego i rtęci na IV stopniu utlenienia, pierwszy znany związek rtęci(IV).
Rtęć, podobnie jak inne pierwiastki grupy 12 układu okresowego (cynk i kadm), ma konfigurację elektronową s2d10 i zasadniczo tworzy wiązania z użyciem orbitalu s. Oznacza to, że najwyższy typowy stopień utlenienia rtęci w związkach wynosi II. Z tego powodu nierzadko prowadzi się spory co do słuszności zaliczania cynkowców do metali przejściowych.
Rozważania nad wyższymi stopniami utlenienia rtęci pojawiły się w latach siedemdziesiątych XX wieku, zaś przeprowadzone dwadzieścia lat później obliczenia wykazały, że związki rtęci(IV) o konfiguracji d8 i geometrii płaskokwadratowej mogą być trwałe w fazie gazowej. Doświadczalnie istnienie tego typu połączeń potwierdzono w 2007 roku, otrzymując HgF
4 na matrycy ze stałego neonu i argonu w temperaturze 4 K. Związek wykryto za pomocą spektroskopii w podczerwieni. Analiza w ramach między innymi teorii funkcjonału gęstości wskazuje, że w tworzenie wiązań zaangażowane są orbitale d. Rtęć zachowuje się więc tu jak typowy pierwiastek przejściowy. Niemniej, za W.B. Jensenem można powiedzieć, że warunki, w jakich istnieje HgF
4 daleko odbiegają od typowych warunków równowagowych i połączenie to powinno być traktowane raczej jako wyjątek.
Badania teoretyczne sugerują, że nietypowa w grupie 12 zdolność rtęci do tworzenia tetrafluorku wynika z relatywistycznej mechaniki kwantowej. Z obliczeń wynika, że dla „mniej relatywistycznych” (lżejszych) pierwiastków tej grupy, cynku i kadmu, tetrafluorki byłyby skrajnie niestabilne i rozpadałyby się do difluorków z eliminacją cząsteczki F
2. Z drugiej strony, tetrafluorek koperniku, powinien być stabilniejszy niż rtęci, lecz doświadczalne potwierdzenie takiej ewentualności spotyka się z problemem krótkiego czasu życia samego pierwiastka.
Bibliografia
- Xuefang Wang i inni, Mercury Is a Transition Metal: The First Experimental Evidence for HgF4, „Angewandte Chememie International Edition”, 46 (44), 2007, s. 8371–8375, DOI: 10.1002/anie.200703710.
- Elusive Hg(IV) species has been synthesized under cryogenic conditions, European Virtual Institute for Speciation Analysis, 12 października 2007 [dostęp 2012-06-14].
- Sebastian Riedel, High Oxidation States: Mercury tetrafluoride synthesized, Psichem.de [dostęp 2012-06-14].
- William B. Jensen, Is Mercury Now a Transition Element?, „Journal of Chemical Education”, 85, 2008, s. 1182–1183, DOI: 10.1021/ed085p1182.c?
| ||||||||||||||||||||||||||||||||||||||||||
Media użyte na tej stronie
The structure of HgF4 drawn in ChemDraw by me
Ball-and-stick model of the mercury(IV) fluoride molecule, HgF4.
Structural information from Xuefang Wang; Lester Andrews; Sebastian Riedel; and Martin Kaupp (2007). "Mercury Is a Transition Metal: The First Experimental Evidence for HgF4.". Angew. Chem. Int. Ed. 46 (44): 8371–8375. DOI:10.1002/anie.200703710.