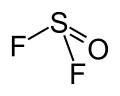
Fluorek tionylu
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||
| Wzór sumaryczny | SOF 2 | ||||||||||||||||||||||||
| Masa molowa | 86,06 g/mol | ||||||||||||||||||||||||
| Wygląd | bezbarwny gaz | ||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||
| Numer CAS | 7783-42-8 | ||||||||||||||||||||||||
| PubChem | 24548 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||
| Podobne związki | chlorek tionylu (SOCl 2), bromek tionylu (SOBr 2) | ||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||
Fluorek tionylu, SOF
2 – nieorganiczny związek chemiczny, bezbarwny gaz o temperaturze topnienia ok. −130 °C i wrzenia ok. −44 °C. Ma strukturę piramidy trygonalnej z atomem siarki na wierzchołku. Kąty O−S−F mają wartość 106,2°, a kąt F−S−F 92,2°[2].
Można go otrzymać w wyniku wymiany chlor–fluor pomiędzy chlorkiem tionylu (SOCl
2), a trifluorkiem antymonu (SbF
3)[2]:
- 3SOCl
2 + 2SbF
3 → 3SOF
2 + 2SbCl
3
Jest również produktem spontanicznej hydrolizy (z wilgoci z powietrza) tetrafluorku siarki (SF
4) powstającego z rozpadu heksafluorku siarki (SF
6) w łuku elektrycznym[4].
Podobnie jak inne halogenowe związki tionylu, łatwo ulega hydrolizie do fluorowodoru i dwutlenku siarki:
- SOF
2 + H
2O → 2HF + SO
2
Przypisy
- ↑ a b c d e f CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 4-90, 9-66, ISBN 978-1-4987-5429-3.
- ↑ a b c d Arnold F. Holleman, Egon Wiberg, Inorganic Chemistry, Academic Press, 2001, s. 542, ISBN 0-12-352651-5.
- ↑ Thionyl fluoride (ZVG: 122707) (ang. • niem.) w bazie GESTIS, Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA). [dostęp 2020-06-25].
- ↑ Federico Pepi i inni, Thionyl Fluoride from Sulfur Hexafluoride Corona Discharge Decomposition: Gas-Phase Chemistry of (SOF2)H+ Ions, „Journal of Physical Chemistry A”, 106 (40), 2002, s. 9261–9266, DOI: 10.1021/jp021074v.
| ||||||||||||||||||||||||||||||||||||||||||
Media użyte na tej stronie
Structure of Thionyl fluoride; Sulfur difluoride oxide; Thionyl difluoride; Sulfurous oxyfluoride; Sulfur difluoride monoxide
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances