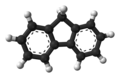
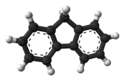
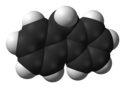
Fluoren
| |||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C13H10 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 166,22 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | białe lub prawie białe kryształy[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | inden, indan | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ten artykuł od 2012-08 wymaga zweryfikowania podanych informacji. |
Fluoren – organiczny związek chemiczny, węglowodór aromatyczny, trójcykliczny.
Otrzymywanie
Fluoren powstaje podczas ogrzewania i spalania materiału organicznego przy niedoborze tlenu. Wydobywa się go z smoły pogazowej. Fluoren powstaje tak jak i wiele innych aromatycznych policykli podczas spalania benzyny oraz olejów napędowych.
Zastosowanie
Fluoren stosuje się do produkcji farb, tworzyw sztucznych oraz pestycydów. Polifluoren jest szeroko rozpowszechniony jako luminofor w polimerowych wyświetlaczach OLED. Fluoren i kilka jego pochodnych działają jako mitogeny, tzn. stymulują podział komórek. Ta właściwość tłumaczy zastosowanie fluorenu i kwasów fluorenokarboksylowych jako środków stymulujących wzrost roślin. W medycynie stosuje się nietoksyczne pochodne fluorenu (np. fluorenon) jako leki wzmagające wzrost tkanek po transplantacji.
Zobacz też
Przypisy
- ↑ a b c d Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- ↑ a b c d wpis w Chemblink.com
- ↑ a b c Fluorene, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2012-08-21] (ang.).
- ↑ a b c d Fluoren (ang.). The Chemical Database. Wydział Chemii Uniwersytetu w Akronie. [dostęp 2012-08-21].[niewiarygodne źródło?]
- ↑ a b c Fluorene (nr 46880) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Symbol of pollutants to the environment, according to the directive 67/548/EWG of 'European Chemicals Bureau (European Chemicals Agency).
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Ball-and-stick model of the fluorene molecule, C13H10
Space-filling model of the fluorene molecule, C13H10