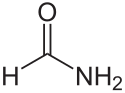
Formamid
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | CH3NO | ||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | HCONH, H−(C=O)−NH | ||||||||||||||||||||||||||||||||||||||
| Masa molowa | 45,04 g/mol | ||||||||||||||||||||||||||||||||||||||
| Wygląd | przezroczysta, bezbarwna, higroskopijna, oleista ciecz[2] o zapachu podobnym do amoniaku[3] | ||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||
Formamid – organiczny związek chemiczny z grupy amidów, pochodzący od kwasu mrówkowego i będący najprostszym przedstawicielem tej klasy związków. Stosowany jest w syntezie organicznej jako rozpuszczalnik oraz plastyfikator.
Otrzymywanie
W przeszłości formamid otrzymywany był dwustopniowo: najpierw w wyniku reakcji kwasu mrówkowego z amoniakiem otrzymywano mrówczan amonu, który następnie ogrzewano:
- HCOOH + NH
3 → HCOONH
4 → HCONH
2 + H
2O
Obecnie przemysłowa metoda otrzymywania formamidu oparta jest na amonolizie mrówczanu metylu:
- HCOOCH
3 + NH
3 → HCONH
2 + CH
3OH
Przypisy
- ↑ Henri A. Favre, Warren H. Powell, Nomenklatura związków organicznych. Rekomendacje IUPAC i nazwy preferowane 2013, Komisja Terminologii Chemicznej Polskiego Towarzystwa Chemicznego (tłum.), Narodowy Komitet Międzynarodowej Unii Chemii Czystej i Stosowanej, [2016], s. 798.
- ↑ a b c Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- ↑ a b c d e Formamide, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 17710 [dostęp 2022-08-11] (niem. • ang.).
- ↑ a b c d e f Haynes 2016 ↓, s. 3-278.
- ↑ Haynes 2016 ↓, s. 5-175.
- ↑ a b Formamide, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2022-08-11] (ang.).
- ↑ Farmakopea Polska VIII, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2008, s. 3491, ISBN 978-83-88157-53-0.
- ↑ Haynes 2016 ↓, s. 6-245.
- ↑ Haynes 2016 ↓, s. 6-192.
- ↑ Haynes 2016 ↓, s. 15-16.
- ↑ Haynes 2016 ↓, s. 9-63.
Bibliografia
- CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, ISBN 978-1-4987-5429-3 (ang.).
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Structure of Formamide