Hatteria
| Sphenodon[1] | |||
| Gray, 1831 | |||
 Samiec hatterii | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Podgromada | |||
| Nadrząd | |||
| Rząd | |||
| Rodzina | |||
| Podrodzina | Sphenodontinae | ||
| Rodzaj | hatteria | ||
| Gatunki | |||
| |||
| Zasięg występowania | |||
 | |||
Hatteria, tuatara, łupkoząb (Sphenodon) – rodzaj gada z rodziny hatteriowatych (Sphenodontidae) występującego endemicznie na Nowej Zelandii. Mimo iż wyglądem najbardziej przypomina jaszczurkę, w rzeczywistości reprezentuje odrębną linię ewolucyjną lepidozaurów – sfenodonty. Hatterie są jedynymi współczesnymi przedstawicielami tej grupy. Ich najbliżsi krewni to łuskonośne (jaszczurki, amfisbeny i węże). Z tego powodu hatteria wzbudza zainteresowanie naukowców badających ewolucję jaszczurek i węży oraz rekonstruujących wygląd i zwyczaje najwcześniejszych diapsydów.
Hatteria ma zielono-brązowe ubarwienie i dorasta do około 60 cm od głowy do koniuszka ogona. Wzdłuż grzbietu biegnie kolczasty grzebień, szczególnie widoczny u samców. Uzębienie, w którym dwa rzędy zębów w szczęce zachodzą na jeden w żuchwie, jest wyjątkowe wśród współczesnych zwierząt. Inna niezwykła cecha to obecność wyraźnego oka ciemieniowego, którego funkcja stanowi przedmiot toczących się badań. Mimo braku małżowin usznych hatterie są zdolne słyszeć. Ich szkielet wykazuje wiele unikatowych cech, spośród których niektóre stanowią ewolucyjną pozostałość po rybach. Mimo iż hatterie bywają określane jako „żywe skamieniałości”, badania paleontologiczne dowodzą, że gady te znacznie zmieniły się od ery mezozoicznej.
Hatterię uznaje się za zagrożoną wyginięciem od 1895. Jak wielu nowozelandzkim zwierzętom, zagraża jej utrata siedlisk oraz introdukcja drapieżników, jak np. szczur polinezyjski. Hatterie wyginęły na dwóch największych wyspach Nowej Zelandii, a zasięg pozostałych populacji ograniczył się do 32 okolicznych wysp, jednak w 2005 roku na terenie ogrodzonego i monitorowanego Karori Wildlife Sanctuary w Wellington odtworzono ich populację.
Ewolucja i taksonomia
Sfenodonty i ich grupa siostrzana, łuskonośne (Squamata), należą do nadrzędu lepidozaurów (Lepidosauria), jedynych współczesnych przedstawicieli grupy Lepidosauromorpha. Zarówno łuskonośne, jak i hatteria mają zdolność do odrzucania ogona w razie zagrożenia oraz poprzeczną szczelinę kloakalną[2]. Linia ewolucyjna sfenodontów oddzieliła się od łuskonośnych prawdopodobnie około 250 mln lat temu[3][4]. Podobieństwo hatteriowatych do jaszczurek jest jedynie powierzchowne, gdyż przedstawiciele tej rodziny wykazują kilka cech niewystępujących u innych gadów. Kształt typowy dla jaszczurek był powszechny u wczesnych owodniowców – jeden z najstarszych znanych gadów, Hylonomus, również przypominał współczesną jaszczurkę[5].
Hatteria została początkowo zaklasyfikowana jako jaszczurka, kiedy w 1831 Muzeum Brytyjskie otrzymało jej czaszkę. Interpretacja ta utrzymywała się do roku 1867, gdy Albert C.L.G. Günther z Muzeum Brytyjskiego spostrzegł podobieństwa do żółwi, krokodyli i ptaków. Dla grupy obejmującej hatterię i jej wymarłych krewnych zaproponował nazwę Rhynchocephalia („ryjogłowe”)[6]. Obecnie większość naukowców używa nazwy Sphenodontia dla mniej obszernej grupy obejmującej Sphenodon i formy pokrewne[7]. Przez lata wiele bliżej niespokrewnionych gatunków zaliczano do Rhynchocephalia, dlatego też grupę tę wielu taksonomów uznawało za „takson-kosz na śmieci”. Samuel Wendel Williston zaproponował w 1925 roku nazwę Sphenodontia dla grupy obejmującej jedynie hatterię i jej najbliższych wymarłych krewnych[8].
Hatterię często określa się jako żywą skamieniałość[9], jednak prace dotyczące ewolucji sfenodontów dowodzą, że grupa ta przeszła liczne zmiany w erze mezozoicznej[10], a sam Sphenodon wykazuje około 20 cech zaawansowanych w stosunku do swoich najbliższych krewnych[11] i określanie go mianem żywej skamieniałości jest niepoprawne[12]. Badania molekularne przeprowadzone przez Jennifer Hay i współpracowników sugerują, że hatteria ma wyższe tempo ewolucji molekularnej niż którekolwiek z przebadanych dotąd zwierząt[13]. Wyniki tej analizy zostały jednak skrytykowane przez Hilary Miller i współautorów, którzy stwierdzili, że tempo ewolucji molekularnej zostało prawdopodobnie przeszacowane[3]. Wniosek ten potwierdziły późniejsze badania kompletnej sekwencji genomu, które wskazują, że hatteria cechuje się najwolniejszym tempem ewolucji molekularnej ze wszystkich zbadanych dotąd lepidozaurów[4]. Niektórzy naukowcy sugerują, że przodkowie hatterii zostali odizolowani od innych sfenodontów około 82 mln lat temu, kiedy Nowa Zelandia oddzieliła się od reszty Gondwany[14]. Inni wskazują, że sfenodonty skolonizowały Nową Zelandię dopiero po jej wynurzeniu z wody, pod którą prawdopodobnie w całości znalazła się około 25–22 mln lat temu – na co wskazuje nieobecność osadów lądowych z tego okresu[15]. Analizy genetyczne sugerują zaskakująco niski poziom zróżnicowania genetycznego wśród hatterii, jak na tak starą linię ewolucyjną. Prawdopodobnie jest to wynikiem efektu wąskiego gardła, który mógł wystąpić w populacji tych gadów podczas cyklów lodowcowych na przełomie pliocenu i plejstocenu[14].
Sfenodonty były grupą stosunkowo liczną w triasie i jurze, jednak ich zapis kopalny z kenozoiku jest ubogi[15]. Najbliższym znanym obecnie krewnym hatterii jest wczesnojurajski Cynosphenodon z obecnych terenów Meksyku[16].
Analizy filogenetyczne wykorzystujące cechy morfologiczne wskazywały na tuatarę jako takson siostrzany łuskonośnych[17], podczas gdy oparte na ograniczonym zestawie danych molekularnych sugerują jej bliższe pokrewieństwo z żółwiami i archozaurami[18][19]. Analiza przeprowadzona przez Michaela Lee (2001) wykorzystująca zarówno cechy morfologiczne, anatomiczne, jak i molekularne, potwierdziła wyniki wcześniejszych analiz morfologicznych[20]. Analizy filogenetyczne gadów wykorzystujące kompletny genom mitochondrialny oraz jądrowy hatterii również wspierają hipotezę o siostrzanych relacjach pomiędzy hatterią a łuskonośnymi[21][4]. Analizy genetyczne grupują Sphenodon punctatus z Cieśniny Cooka bliżej populacji z North Brother (dawniej uznawanej za osobny gatunek S. guntheri) – również występującej na terenie Cieśniny Cooka – niż północnej populacji S. punctatus. Wyniki te są zgodne z zasięgiem występowania obu gatunków, jednak stoją w sprzeczności z allozymowym zróżnicowaniem genetycznym[22].
Nazwa „tuatara”, będąca jednym z określeń hatterii, pochodzi z języka maoryskiego i oznacza „kolczasty grzbiet”[23], zaś systematyczna Sphenodon – od greckich słów σφήν/sphen („klin”) i ὀδούς/odous („ząb”)[24]. Początkowo Gray nadał rodzajowi nazwę Sphaenodon, jednak Międzynarodowa Komisja Nomenklatury Zoologicznej w 1957 roku zaakceptowała jej zmianę na Sphenodon[25].
Gatunki
Po 1990 roku przeważnie wyróżniano dwa współczesne gatunki hatterii – Sphenodon punctatus, nazywany niekiedy po prostu hatterią, i znacznie rzadszy Sphenodon guntheri (hatteria niespodziana), którego zasięg występowania ogranicza się do północnej z wysp The Brothers w Cieśninie Cooka[26]. Nazwa gatunkowa punctatus pochodzi z łaciny i oznacza „plamisty”, zaś guntheri honoruje Alberta Günthera. S. punctatus został nazwany, gdy znany był tylko jeden gatunek, dlatego też jego nazwa jest myląca, ponieważ przedstawiciele obydwu gatunków mają plamy. S guntheri ma oliwkowobrązową skórę z żółtymi plamami, podczas gdy ubarwienie S. punctatus waha się od oliwkowozielonego, przez szary, do ciemnoróżowego lub ceglastoczerwonego, zawsze z białymi plamami[2][23][27]. S. guntheri jest w dodatku znacznie mniejszy[28]. Sphenodon guntheri został rozpoznany jako odrębny gatunek w 1877 roku przez Waltera Bullera[29], jednak do roku 1990 S. guntheri był przeważnie klasyfikowany w obrębie S. punctatus[30]. Po 1990 większość naukowców zgadzała się co do zasadności wyodrębnienia S. guntheri jako osobnego gatunku, jednak badania Jennifer Hay i współpracowników z 2010 roku sugerują, że S. punctatus i S. guntheri reprezentują nie osobne gatunki, lecz odmiany geograficzne tego samego gatunku[31]. Analizy kompletnego genomu hatterii potwierdzają odrębność populacji z North Brother, jednak nie na poziomie gatunkowym, w związku z czym nazwa S. guntheri jest obecnie uznawana za synonim nazwy S. punctatus[4]. Kolejny gatunek hatterii – podobny do dwóch poprzednich, lecz nieco mniejszy – zidentyfikował w listopadzie 1885 roku William Colenso, który opisał go w oparciu o na wpół skamieniały okaz i nazwał S. diversum[32]. S. punctatus dzieli się na dwa podgatunki – S. punctatus punctatus, występujący na Bay of Plenty i wyspach położonych dalej na północ, oraz S. punctatus reischeki[33], którego przedstawiciele żyją w okolicy Cieśniny Cooka[34]. W 2009 roku opisano trzy niekompletne kości zębowe należące do przedstawicieli grupy Sphenodontinae, przez autorów przypisane wstępnie do rodzaju Sphenodon, pochodzące z wczesnego miocenu, około 19–16 mln lat temu. Jeśli interpretacja ta jest prawidłowa, byłyby to najstarsze znane skamieniałości hatterii[15].
Budowa
Hatterię uznaje się za najmniej wyspecjalizowanego współczesnego owodniowca – mózg i sposób poruszania się przypominają płazie, a serce jest bardziej prymitywne niż u innych żyjących obecnie gadów[35]. Płuca składają się z jednej komory, a oskrzela w ogóle nie występują[36]. U obu gatunków występuje dymorfizm płciowy przejawiający się rozmiarami – samce są większe. Dorosły samiec S. punctatus mierzy 61 cm długości, a samica 45 cm[2]. Niektóre źródła jako maksymalną długość podają 80 cm[37][38]. Samce ważą do 1 kg, samice – do 0,5 kg. Sphenodon guntheri ważą do 660 g i osiągają mniejsze rozmiary[28] – długość od pyska do kloaki u samic dochodzi do 21,3 cm[39].
Zielonobrązowy kolor hatterii odpowiada ich środowisku i może być modyfikowany w ciągu życia[27]. Ciemniejsze ubarwienie wynika z intensywnej pigmentacji β-keratynocytów naskórka. Tuatary nie są wyraziście ubarwione i nie potrafią szybko zmieniać swego ubarwienia[40]. Hatteria zmienia skórę co najmniej raz w roku jako dorosła[27] i trzy – cztery razy jako młoda. Kolczasty grzebień na grzbiecie zwierzęcia, zbudowany z trójkątnych miękkich płatów skóry, większy u samców, może być nastroszony, kiedy tuatara jest zdenerwowana[41].
Czaszka
Czaszka diapsydów przeszła liczne ewolucyjne zmiany, jednak wszystkie jej cechy charakterystyczne są obecne u hatterii – ma ona dwa okna po obu stronach czaszki z pełnymi łukami. Kość szczękowa mocno wiąże się z resztą czaszki[2]. Sprawia to, że bardzo sztywną, nieelastyczną konstrukcję czaszki występującą u żółwi (anapsydalną) uważa się za najbardziej prymitywną wśród owodniowców, choć możliwe jest, że żółwie są w rzeczywistości diapsydami, które wtórnie utraciły otwory skroniowe[42][18]. Hatteria jest jedynym współczesnym lepidozaurem mającym całkowicie diapsydalną czaszkę[43]. Obecność w pełni wykształconego dolnego łuku skroniowego – będącego połączeniem kości kwadratowej i kwadratowo-jarzmowej – była powszechnie uznawana za cechę prymitywną, zaś jego brak u łuskonośnych za zaawansowaną, jednak odkrycia paleontologiczne i analizy filogenetyczne sugerują, że to nieobecność łuku jest prymitywna wśród lepidozaurów[44].
Współczynnik encefalizacji hatterii jest stosunkowo niski – wynosi 70,2, podobnie jak u jaszczurek z rodziny szyszkowcowatych, jednak znacznie mniej niż u przedstawicieli Lacertidae (EQ 100). W większości części mózgu wskaźniki te również są dość niskie, z wyjątkiem nadwzgórza (359), wzgórza (118) oraz móżdżka (121). Porównanie z jaszczurkami sugeruje podobieństwa do Lacertomorpha (typ I jaszczurek), uznawanymi za mniej zaawansowane niż Dracomorpha (typ II jaszczurek)[45].
Czubek szczęki przypomina dziób, od zębów oddziela go niewielki wzgórek. W szczęce znajdują się dwa rzędy zębów, podczas gdy w żuchwie jeden – znajdujący się dokładnie pomiędzy rzędami zębów szczękowych, gdy szczęki są zamknięte. Układ ten stanowi wyjątek wśród współczesnych gadów – mimo iż większość węży ma w szczęce dwa rzędy zębów, pełnią one inne funkcje niż u hatterii. Szczęki, łączone więzadłem, są w stanie wykonywać zarówno żujące ruchy na boki, jak i gryzące, wertykalne[2]. Siła ugryzienia wystarcza do przebijania chityny i przebijania skorupek jaj[46], jednak jest stosunkowo niższa niż u innych współczesnych lepidozaurów[43] – według analizy Curtisa i in. (2011) wynosi ona około 140 N[46]. Siła zacisku szczęk różni się jednak w zależności od płci i pozycji w jamie gębowej – samce gryzą silniej niż samice, a siła nacisku jest największa z tyłu szczęk. U samic wynosi ona maksymalnie 163,5 N (z przodu 81,8 N), a u samców 238,3 N (z przodu 119,1 N)[47]. Istotną rolę w chwytaniu pożywienia i manipulowaniu nim odgrywa również duży, mięsisty język[48]. Mimo iż liczne aspekty odżywiania hatterii są zaawansowane, występuje również wiele cech prymitywnych. Sugerują one, iż anatomia języka hatterii może być przydatna przy rekonstruowaniu cech występujących u wczesnych tetrapodów. Język hatterii ma wiele potencjalnych wspólnych cech prymitywnych z językiem jaszczurek z rodziny legwanowatych[49]. Badania przeprowadzone na komputerowym modelu czaszki hatterii sugerują, że określona grupa mięśni kontroluje konkretne ruchy szczęk, a podczas danego momentu ukąszenia niektóre mięśnie wykazują wysoką aktywność, podczas gdy inne pozostają nieaktywne. Analizy te przynoszą podobne rezultaty, co wcześniejsze badania przeprowadzone na żywych tuatarach przy wykorzystaniu elektromiografii. Różnice wytłumaczyć można twardością pożywienia, jego rozmiarem i położeniem w szczękach oraz ruchami żuchwy[50]. Czaszka hatterii jest optymalnie przystosowana do wytrzymywania działających na nią sił: niektóre jej rejony – sił rozciągających, a inne – ściskających[46]. Hatteria ma uzębienie akrodontyczne, jej zęby są przyrośnięte do kości szczęk, dlatego ich zastępowanie nowymi w razie uszkodzeń jest utrudnione[51]. U dorosłych zęby żuchwy mają kształt piramidalny, z wierzchołkiem zwróconym ku przodowi i zgrubieniami na stronie przednio-przyśrodkowej i przednio-wargowej, zęby szczęki są stożkowate z niewielkim zgrubieniem z tyłu, natomiast u młodych zęby żuchwy są stożkowate i lekko spłaszczone wargowo-językowo. W trakcie ontogenezy hatterii powiększa się obszar zaoczodołowy, staw żuchwowy przemieszcza się ku stronie brzusznej oraz rozwija się grzebień ciemieniowy[52]. Samce mają większe głowy i większą siłę zgryzu niż samice[47][53].
Szkielet pozaczaszkowy
Kręgosłup hatterii złożony jest z klepsydrowatych kręgów, zarówno przodo-, jak i tyłowklęsłych[51]. Stanowi to cechę typową dla ryb i niektórych płazów, jednak odróżnia tuatarę od innych owodniowców.
Hatteria ma gastralia, przypuszczalną plezjomorfię tetrapodów[54]. Występują one u niektórych jaszczurek, u których buduje je przeważnie chrząstka, oraz krokodyli i hatterii i nie łączą się z kręgosłupem lub żebrami piersiowymi. Prawdziwe żebra są niewielkimi wybrzuszeniami z wyrostkami haczykowatymi na spodniej stronie każdego żebra[51]. Cecha ta występuje również u ptaków[55]. Hatteria to jedyny współczesny czworonóg mający dobrze wykształcone zarówno gastralia, jak i wyrostki haczykowate[56].
U wczesnych czworonogów gastralia i żebra z wyrostkami haczykowatymi tworzyły wraz z innymi kostnymi elementami, takimi jak osteodermy i obojczyk, rodzaj egzoszkieletu pełniącego funkcje obronne. Cechy te najprawdopodobniej wyewoluowały ze struktur służących do poruszania się jeszcze przed skolonizowaniem lądu przez kręgowce. Sugerowano, iż gastralia mogły odgrywać rolę w wentylacji[54][55].
Podobnie jak łuskonośne, hatteria potrafi odrzucać ogon, jednak mechanizm ten jest u niej poznany gorzej niż u Squamata. W przeciwieństwie do przedstawicieli tej grupy, ogon hatterii jest stosunkowo tej samej długości u obu płci, regeneruje się również w zbliżonym tempie. Autotomia przeważnie przebiega śródkręgowo[57].
Narządy zmysłów
Oczy mogą akomodować niezależnie i mają specjalną „podwójną siatkówkę” zawierającą dwa typy komórek wzrokowych, umożliwiających widzenie zarówno w dzień, jak i w nocy, oraz błonę odblaskową. Na każdym oku znajduje się również trzecia powieka. Może być ona przesuwana poziomo od wewnątrz do zewnątrz oka, podczas gdy górna i dolna powieka pozostają otwarte[37].
Na szczycie głowy hatterii znajduje się trzecie oko, zwane okiem ciemieniowym. Pod względem histologii jest bardzo podobne do prawdziwych oczu, nie wykazuje jednak bocznej symetrii, co stanowi cechę nietypową u zwierząt dwubocznie symetrycznych, takich jak kręgowce[58]. Ma ono własną soczewkę, rogówkę, siatkówkę i zdegenerowany nerw łączący je z mózgiem, co sugeruje, że wyewoluowało z prawdziwego oka. Oko ciemieniowe widać tylko u młodych, które mają półprzezroczystą plamę na środku czaszki. Po około sześciu miesiącach zostaje ona pokryta nieprzejrzystymi łuskami i pigmentem[2]. Funkcje oka ciemieniowego pozostają niejasne[59] – może być ono wykorzystywane do absorpcji promieni ultrafioletowych do produkcji witaminy D[60], jak również do określania cyklu światło-ciemność i pomocy w termoregulacji[2]. Oko ciemieniowe jest u hatterii zachowane najlepiej spośród wszystkich współczesnych tetrapodów. Wchodzi ono w skład kompleksu szyszynki, do którego należy również szyszynka. Wykazano, że niektóre salamandry wykorzystują szyszynkę do postrzegania spolaryzowanego światła, dzięki czemu mogą ustalać pozycję Słońca nawet przy zachmurzeniu, co ułatwia nawigację[61].
Wraz z żółwiami hatteria ma najbardziej prymitywne narządy słuchu pośród owodniowców. Nie mają one błony bębenkowej ani otworów usznych[51], a ucho środkowe wypełnia głównie tkanka tłuszczowa. Strzemiączko styka się z kością kwadratową, jak również gnykową i łuskową. Komórki rzęsate nie uległy specjalizacji i odpowiadają jedynie na niskie częstotliwości. Mimo iż narządy słuchu są kiepsko wykształcone i prymitywne, a zewnętrzne uszy nie występują, wciąż są one w stanie odpowiadać na częstotliwości od 100 do 900 herców, z największą czułością na dźwięki osiągające 200–400 Hz[62] i 40 dB[63].
Istotną rolę odgrywają bodźce wzrokowe[64] i smakowe[49].
Biologia
Dorosłe hatterie są zwierzętami lądowymi i nocnymi, chociaż często wygrzewają się w promieniach Słońca. Młode chowają się pod pniami i kamieniami i są aktywne w dzień, prawdopodobnie ze względu na kanibalistyczne zachowania przejawiane przez dorosłe. Hatteria zachowuje aktywność w znacznie niższych temperaturach niż większość gadów i hibernuje w zimie[65]. Pozostaje aktywna, gdy temperatura jej ciała wynosi zaledwie 5,2 °C[66], natomiast temperatura powyżej 28 °C może być śmiertelna[67]. Optymalna temperatura dla tuatary wynosi 16–22 °C – najmniej ze wszystkich gadów[66]. Niska temperatura ciała skutkuje także wolniejszym metabolizmem. Hatterie są długowiecznymi zwierzętami, nie stwierdzono u nich znaczącej zachorowalności i umieralności związanej z chorobami zakaźnymi, co sugeruje, iż wykazują one bardzo efektywną odporność. Prawdopodobnie u tuatar występują limfocyty T – nie jest jednak pewne, czy – jeśli rzeczywiście są u nich obecne – pełnią te same funkcje, co u wyższych kręgowców, czy też odmienne lub dodatkowe, wynikające z przystosowań do chłodniejszych temperatur[68]. Sekwencja genów głównego układu zgodności tkankowej jest odmienna niż u innych współczesnych gadów, co także wspiera hipotezę o starodawności linii ewolucyjnej hatterii[69]. Genom tuatary jest o ponad 40% większy od ludzkiego, jednak jakość jej biblioteki genomowej jest porównywalna z bibliotekami genomowymi sztucznego chromosomu bakteryjnego pozostałych kręgowców. Fizjologia i historia naturalna hatterii sugeruje, że ich genom może mieć wiele cech zaawansowanych[70]. Jego duży rozmiar może wynikać z nagromadzenia powtarzających się sekwencji[71]. Może mieć on również istotne znaczenie w kwestii lepszego zrozumienia ewolucji ludzkiego genomu, ponieważ w niemal niezmienionej formie występuje w nim retropozon będący ewolucyjnym prekursorem jednego z 18 elementów odpowiedzialnych za regulację ekspresji genu ASXL3 (w ewolucji ssaków retropozon ten szybko uległ inaktywacji)[72]. Hatteria jest diploidem – liczba chromosomów wynosi 2n=36. Samce i samice nie różnią się chromosomami, choć u niektórych osobników może występować ich strukturalny heteromorfizm[73]. Kariotyp hatterii składa się z 28 makrochromosomów i 8 mikrochromosomów[71].
U gadów sezonowa zmienność w rozmieszczeniu i funkcji leukocytów jest większa niż u którejkolwiek z przebadanych dotąd grup kręgowców. Hatteria ma eozynofile, neutrofile, bazofile i limfocyty. Bazofile są stosunkowo dużych rozmiarów, zaś eozynofile nie zawierają ciał krystalicznych. Prawdopodobnie u tuatar występują także limfocyty B[74].
Grzebiące ptaki, takie jak burzykowate, podczas sezonu lęgowego żyją na tych samych terenach, co hatterie. Tuatary wykorzystują ptasie nory jako schronienia, lecz są również w stanie kopać własne. Guano ptaków morskich pomaga utrzymać liczebność populacji bezkręgowców, którymi żywią się hatterie[75]. Ich dieta obejmuje chrząszcze, świerszczowate i pająki, a także płazy bezogonowe, jaszczurki oraz ptasie jaja i pisklęta[2], jednak tylko dorosłe – zwłaszcza duże samce – zjadają kręgowce[52]. Okresowo dostępne jaja i pisklęta ptaków morskich mogą dostarczać egzogennych kwasów tłuszczowych[2]. Główne pożywienie tuatar to duże owady, jednak ich dieta zależy od pory roku i otoczenia[76]. Podobnie jak niektóre jaszczurki, mogą wykorzystywać zmysły chemiczne do wykrywania zdobyczy[77]. Hatterie obu płci bronią swego terytorium i potrafią mocno ugryźć napastnika[78]. Ich struktura społeczna jest podobna do występującej u jaszczurek należących do rodzin legwanowatych, długonogwanowatych i frynosomowatych[64]. Podrażnione hatterie głośno skrzeczą, syczą i skomlą[41].
Rozmnażanie

Hatteria rozmnaża się bardzo wolno, dojrzałość płciową osiąga po dziewięciu-trzynastu latach, w zależności od cech osobniczych i populacji[80]. Gody odbywają się w okolicach przesilenia letniego[81]. Samice kopulują i składają jaja przeważnie raz na cztery – pięć lat, jednak cecha ta jest zmienna – obserwowano samice gnieżdżące się po dwóch latach od poprzedniego lęgu, jak i po pięciu latach[82], a u S. guntheri – nawet po dziewięciu latach[83]. Kopulacja, owulacja i składanie jaj mają miejsce zwykle w ostatnim roku cyklu, przez poprzednie lata trwa witelogeneza. Samica składa jaja po 6–8 miesiącach od kopulacji[81]. W zależności od populacji składa średnio 1,27–2,28 jaja rocznie[82]. Podczas godów samce stają się ciemniejsze, unoszą grzebienie i paradują przed samicami, powoli chodząc wokół na sztywnych nogach. Samica albo pozwoli samcowi się pokryć, albo wycofa do swej nory[84]. Duże samce kopulują częściej niż mniejsze, gdyż potrafią opanować terytorium, na którym gęstość samic jest największa, i obronić je przed agresywnymi konkurentami[85]. Siła zgryzu nie odgrywa roli w doborze partnera w trakcie okresu rozrodczego, jednak samce mające większą bezwzględną, choć nie względną, siłę ugryzienia częściej kopulują[53]. Spermatocytogeneza zachodzi przez cały rok, choć prawdopodobnie bardzo powoli zimą. Spermiogeneza normalnie występuje od środka wiosny do środka lata, a ustaje podczas pięciu lub sześciu najzimniejszych miesięcy[86]. Samce nie mają prącia – kopulują, unosząc ogon samicy i przytykając swoją kloakę do jej steku[87]. Brak prącia nie wpływa jednak na istotne modyfikacje plemników. W plemnikach hatterii występuje wiele symplezjomorfii z krokodylami i w szczególności żółwiami, brak w nich jednak cech zaawansowanych diagnostycznych dla łuskonośnych, co bywa interpretowane jako argument przeciwko bliskiemu pokrewieństwu pomiędzy sfenodontami i łuskonośnymi[88]. Zarówno u samców, jak i u samic koncentracja hormonów płciowych w trakcie okresu godowego jest najwyższa w przeciągu roku. Poziom estrogenu gwałtownie spada natychmiast po godach i pozostaje niski przez okres, kiedy samica nosi jaja[74]. Gniazdowanie przebiega podobnie u obu gatunków hatterii. Samice kopią gniazda od wczesnego do środkowego listopada, niekiedy wykorzystują to samo miejsce z roku na rok. Hatterie gniazdują przeważnie w otwartych, nasłonecznionych lokalizacjach[89]. Tunele drążone przez hatterie mierzą zazwyczaj około 197 mm długości, 73 szerokości i 45 wysokości. W tylnej części są lekko rozszerzone. W jednym gnieździe znajduje się średnio 8,6 jaja[90]. Samice opiekują się gniazdami, przy czym często bronią innego, niż wykopane przez siebie. Średnio co czwarte gniazdo jest później rozkopywane przez inną samicę[91].
Jaja hatterii mają miękką, przypominającą pergamin skorupkę, zbudowaną ze składników wapiennych i włóknistych[92]. Wytworzenie jaj z żółtkami zajmuje samicy od roku do trzech lat, a skorupek – do siedmiu miesięcy. Oznacza to, że cykl rozrodczy tuatary trwa od dwóch do pięciu lat, najdłużej ze wszystkich współczesnych gadów[2]. Dziko żyjące hatterie są w stanie rozmnażać się w wieku co najmniej 55–60 lat[93], jednak w niewoli mogą płodzić potomstwo w znacznie późniejszym wieku – w styczniu 2009 roku wykluły się hatterie będące potomkami żyjących w Southland Museum w Invercargill 111-letniego „Henry’ego” i 80-letniej „Mildred”[94].
Płeć młodych zależy od temperatury jaj[95] – ze znajdujących się w cieplejszym otoczeniu wykluwają się samce, a w chłodniejszym – samice. Zarodki inkubowane w stałej temperaturze 18 lub 22 °C staną się samicami, podczas gdy trzymane w temperaturze 18 °C, zwiększonej następnie do 23 °C, a potem obniżonej ponownie do 18 °C, zawsze będą samcami. Sugeruje to, że przekształcenie samicy w samca następuje w temperaturze około 22 °C. U hatterii występuje rzadki wzorzec płci zależnej od temperatury (FM; samica → samiec) i chociaż nie można wykluczyć również obecności bardziej powszechnego wzorca (FMF; samica → samiec → samica), przy temperaturze przemiany samca w samicę wynoszącej ponad 23–24 °C – wydaje się on mało prawdopodobny. Występowanie u hatterii wzorca FM ma istotne znaczenie dla struktury ich populacji – w obliczu globalnego ocieplenia może doprowadzić do dalszego wzrostu liczebności samców kosztem samic[96]. Tendencja ta jest szczególnie zauważalna w niektórych populacjach[39], takich jak S. guntheri, gdzie cały gatunek – przy braku pomocy człowieka – może wyginąć, ponieważ w naturalnym środowisku wylęgać będą się jedynie samce[83]. Wysoka temperatura skraca okres inkubacji – przy 18 °C wynosi on 328 dni, przy 20 °C – 259 dni, przy 22 °C – 169 dni, a przy 25 °C – 150 dni[97]. Na wielkość nowo wyklutej hatterii początkowa masa jaja wpływa w większym stopniu niż temperatura, w jakiej było ono inkubowane. Stała temperatura inkubacji wpływa na zwiększenie rozmiarów hatterii po dziesięciu miesiącach, lecz są one prawdopodobnie mniej agresywne niż te inkubowane w warunkach naturalnych. W wieku 10 miesięcy dymorfizm płciowy jest słabo uzewnętrzniony, choć występują już pierwsze cechy zróżnicowania, takie jak wielkość szczęk[98].
Tuatara rośnie prawdopodobnie najwolniej ze wszystkich współczesnych gadów[2] – tempo wzrostu zwiększa się wraz z temperaturą. Analizy szkieletochronologiczne paliczków hatterii z wysp Stephens i Lady Alice sugerują, że tempo wzrostu zauważalnie spada po osiągnięciu 15–20 lat u samic i 20–25 lat u samców. Pierścienie przyrostowe na kościach udowych pozostają wyraźne do 35. roku życia zwierzęcia[80]. Maksymalna długość życia hatterii nie jest znana – na wolności wynosi ona co najmniej 83 lata[68]. W niewoli może przekraczać sto lat, a niektórzy uważają, że zdrowe osobniki mogą dożywać dwustu lat[99].
Ochrona
Zasięg występowania i zagrożenia
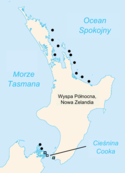
Zasięg występowania hatterii był długo ograniczony do 32 przybrzeżnych wysp wolnych od ssaków[34]. Na wyspy te trudno jest się dostać[101], więc skolonizowało je niewiele gatunków, co dowodzi, że niektóre zwierzęta niewystępujące na tych wyspach mogły powodować zanikanie hatterii na lądzie stałym. Niedawno jednak szczur polinezyjski (kiore, Rattus exulans) zasiedlił niektóre spośród tych wysp – populacje hatterii utrzymały się, jednak gady zaprzestały rozmnażania[102][103]. Na wyspach zasiedlonych przez szczury tuatary były także znacznie rzadsze[103]. Badania wykazały, iż obecność szczurów pacyficznych nie wpływa jednak negatywnie na wielkość nowo wyklutych hatterii ani wskaźnik samic noszących jaja. Gady żyjące na wyspach, na których występowały również kiore, są w zdecydowanie gorszej kondycji niż występujące na wyspach wolnych od szczurów. Przyrost naturalny hatterii jest zredukowany w obecności Rattus exulans. Możliwe, iż obecność szczurów pacyficznych negatywnie wpływa na wykluwalność jaj oraz kondycję nowo wyklutych hatterii[104], które niekiedy polują na młode tuatary[105], a także współzawodniczą z dorosłymi o pokarm, jak np. ptaki morskie[106]. Zagrożeniem jest też ocieplenie klimatu, które zaburza strukturę płciową populacji, sprawiając, że z jaj wykluwa się więcej samców niż samic[107][83].
Niedawne odkrycia młodych hatterii na Nowej Zelandii dowodzą, że próby reintrodukcji tuatar przynoszą pewne efekty. Ogólną liczebność hatterii wszystkich gatunków i podgatunków ocenia się na ponad 60 000 osobników[2], lecz mniej niż 100 000[108], a według innych źródeł liczba dorosłych osobników nie przekracza 20 000 i jest względnie stała[109]. W Czerwonej księdze gatunków zagrożonych Sphenodon punctatus jest uważany obecnie za gatunek najmniejszej troski[110], a S. guntheri – za zagrożony[111], jednak oba te statusy zostały nadane w 1996 roku i wymagają aktualizacji. Z kolei według kryteriów New Zealand Threat Classification System (NZTCS) hatteria (traktowana tam jako jeden gatunek) należy do kategorii „narażonych” (At Risk), a wewnątrz niej do „reliktowych”, z powodu ograniczonego zasięgu (poniżej 1000 km²). W przypadku niepodjęcia działań ochronnych prawdopodobne jest zaklasyfikowanie jej do kategorii bardziej zagrożonych gatunków[109].
Zwalczanie szczurów
Hatterie zostały usunięte z archipelagu Mercury oraz Cuvier Island w 1990 i 1991 i utrzymywane w niewoli, co miało umożliwić zwalczenie szczurów żyjących na tych wyspach. Wszystkie trzy populacje rozmnażały się w niewoli i po usunięciu szczurów ponownie wypuszczono je na wolność. W latach 1991–1992 na Little Barrier Island stwierdzono jedynie osiem hatterii, które następnie schwytano i zapewniono ochronę in situ. Złapane samice złożyły 42 jaja, które następnie inkubowano w Victoria University. Małe hatterie przetrzymywano w niewoli na wyspie, a po wytępieniu szczurów w 2006 roku, uwolniono[112].
Spośród grupy wysp Hen and Chicken na Pacyfiku szczury usunięto z Whatupuke w 1993 roku, z Lady Alice Island w 1994 i z Coppermine Island w 1997. Na tych trzech wyspach widziano młode tuatary. Na Hen Island, należącej do tej samej grupy wysp, szczury są wciąż obecne i młodych hatterii nie obserwowano tam od 2001. Spośród wysp Alderman na środkowej nie występują tuatary – szczury mogą prawdopodobnie przepłynąć na nią z sąsiednich wysp – by to uniemożliwić zostały wytępione w 1992 roku. W 2004 szczury usunięto również z Rangitoto Islands, przygotowując teren do wypuszczenia 432 młodych hatterii hodowanych w Victoria University od 2001 roku[100].
Hatterie z North Brother
Zasięg występowania tej linii ewolucyjnej ogranicza się do jednej niewielkiej wyspy, a ogólna liczebność populacji wynosi około 400 osobników. W 1995 roku 50 młodych i 15 dorosłych zwierząt przeniesiono na Titi Island w Cieśninie Cooka, a populację monitorowano. Dwa lata później ponad połowę hatterii zaobserwowano ponownie i wszystkie poza jedną przybrały na wadze. W 1998 roku 34 wyklute w niewoli młode i 20 złapanych na wolności dorosłych przeniesiono na Matiu Island, bardziej dostępne miejsce[100]. Pod koniec października 2007 ogłoszono, że 50 hatterii zebranych jeszcze jako jaja w North Brother Island i wyklutych w Victoria University, wypuszczono na wolność w Long Island. Zwierzęta hodowano w ogrodzie zoologicznym w Wellington. Zbudowano dla nich specjalne pomieszczenie i nie pokazywano publiczności[113].
Mimo stosunkowo niewielkiej liczebności i ograniczonego zasięgu występowania, długoterminowe prognozy są korzystne – tuatary z North Brother Island są długowieczne, dorosłe osobniki obu płci mają wysoki wskaźnik przeżywalności (0,95). W populacji znacznie liczniejsze są samce – na jedną samicę przypada średnio 1,7 samca[39]. Z tego powodu hatterie z North Brother mogą wymagać pomocy człowieka, ponieważ w wyniku ocieplenia klimatu wylęgać się będzie coraz więcej samców i coraz mniej samic[83]. Przy niesprzyjających zmianach klimatu w połowie lat 80. XXI wieku na wszystkich stanowiskach tego gatunku mogłyby się wykluwać wyłącznie samce[107]. Interwencje człowieka co dwa – trzy lata prawdopodobnie mogłyby jednak zatrzymać ten proces[83]. Receptą mogłoby też być przenoszenie populacji zwierząt na tereny, na których mogłyby przetrwać ocieplenie – plan takiej operacji opracowano już dla S. punctatus[114].
Sphenodon punctatus
Sphenodon punctatus (nie licząc populacji z North Brother) występuje naturalnie na 29 wyspach, a jego populację szacuje się na ponad 60 000 osobników[2]. W 1996 roku 32 dorosłe hatterie przeniesiono z Moutoki Island na Whale Island. Whale Island (Moutohora) jest w stanie utrzymać populację około 8500 hatterii, co umożliwia obserwowanie tuatar na wolności[100].
Na stały ląd hatterie wypuszczono w 2005 roku na terenie ogrodzonego i monitorowanego Karori Wildlife Sanctuary[23]. Drugie uwolnienie miało miejsce w październiku 2007 roku, kiedy kolejne 130 osobników przeniesiono ze Stephens Island do Karori Sanctuary[115]. W marcu 2009 po raz pierwszy od ponad dwustu lat obserwowano hatterie wyklute na wolności na nowozelandzkim stałym lądzie[116].
Rozmnażanie w niewoli
Hatterie są stosunkowo łatwe w utrzymaniu w niewoli, jednak próby ich rozmnażania przeważnie kończyły się niepowodzeniem[117].
W Nowej Zelandii prowadzonych jest kilka programów mających zwiększyć liczebność hatterii dzięki rozmnażaniu jej w niewoli. Pierwszy tego typu program przeprowadzało Southland Museum and Art Gallery. Również ogrody zoologiczne w Hamilton i Wellington rozmnażają hatterie, by później wypuścić je na wolność. Uniwersytet Wiktorii w Wellington prowadzi badania nad trzymanymi w niewoli tuatarami. Pukaha Mt Bruce Wildlife Centre hoduje parę i jedną młodocianą hatterię. WildNZ Trust ma zagrodę hodowlaną dla tuatar w Ruawai. W styczniu 2009 roku z jedenastu jaj należących do hatterii o przezwiskach „Henry” i „Mildred” wykluły się młode. Było to możliwe dzięki operacji usunięcia guza nowotworowego, który hamował zarówno zdolność, jak i chęć „Henry’ego” do rozmnażania[118].
Hatteria w kulturze
Hatterie występują w wielu miejscowych legendach i uznaje się je za ariki, formy boskie. Są uważane za posłańców Whiro, boga śmierci i katastrof, a kobietom Māori nie wolno ich zjadać[119]. Hatterie wyznaczają również tapu (granice tego, co uświęcone i ograniczone), powyżej których jest mana, oznaczająca, że za przekroczenie granicy grożą poważne konsekwencje. Kobiety Māori niekiedy w okolicach narządów płciowych tatuują jaszczurki, niektóre tatuaże mogą też przedstawiać hatterie[120]. Obecnie tuatary uważa się tam za taonga („specjalny skarb”)[121].
Hatteria była przedstawiona na pięciocentowej monecie nowozelandzkiej, wycofanej z obiegu w sierpniu 2006 roku oraz na srebrnych kolekcjonerskich monetach wydanych w 2007 w nominałach 10 ¢ i 5 $[122]. Poczta nowozelandzka wyemitowała kilka znaczków pocztowych przedstawiających tuatarę. Pierwszym z nich był znaczek o nominale 8 pensów[123], wyemitowany 1 maja 1935 r. (z reedycją w 1936 r.)[124]. Kolejne ukazały się 17 kwietnia 1991 r. pod patronatem WWF w postaci serii czterech znaczków z podobizną tuatary (każdy o nominale 40 ¢)[125], a ostatni, o nominale 45 ¢, 7 marca 2007 r. w serii New Zealand Native Wildlife (pol. Rodzima Przyroda Nowej Zelandii)[126].
„Tuatara” to również nazwa czasopisma wydawanego przez Biological Society of Victoria University College, a następnie Uniwersytet Wiktorii w latach 1947–1993[127].
Przypisy
- ↑ Sphenodon, [w:] Integrated Taxonomic Information System [online] (ang.).
- ↑ a b c d e f g h i j k l m Alison Cree: Tuatara. W: Tim Halliday, Kraig Adler (red.): The new encyclopedia of reptiles and amphibians. Oxford: Oxford University Press, 2002, s. 210–211. ISBN 0-19-852507-9.
- ↑ a b Hilary C. Miller, Jennifer A. Moore, Fred W. Allendorf, Charles H. Daugherty. The evolutionary rate of tuatara revisited. „Trends in Genetics”. 25 (1), s. 13–15, 2009. DOI: 10.1016/j.tig.2008.09.007 (ang.).
- ↑ a b c d Neil J. Gemmell i inni. The tuatara genome reveals ancient features of amniote evolution. „Nature”, 2020. DOI: 10.1038/s41586-020-2561-9 (ang.).
- ↑ Hylonomus: The Earliest Reptile (ang.). Natural History Notebooks. Canadian Museum of Nature. [dostęp 2011-07-16].
- ↑ Albert Günther. Contribution to the anatomy of Hatteria (Rhynchocephalus, Owen). „Philosophical Transactions of the Royal Society of London”. 157, s. 595–629, 1867. DOI: 10.1098/rstl.1867.0019. JSTOR: 108983 (ang.).
- ↑ Lepidosauromorpha. Lizards, snakes, Sphenodon, and their extinct relatives (ang.). Tree of Life Web Project. [dostęp 2011-07-16].
- ↑ Phylogeny. W: Nicholas C. Fraser, Hans-Dieter Sues (red.): In the Shadow of the Dinosaurs: Early Mesozoic Tetrapods. Cambridge: Cambridge University Press, 1994. ISBN 0-521-45242-2.
- ↑ TerraNature: Tuatara (ang.). New Zealand Ecology: Living Fossils. [dostęp 2011-07-16].
- ↑ Wu Xiaochun: Late Triassic-Early Jurassic sphenodontians from China and the phylogeny of the Sphenodontida. W: Nicholas C. Fraser, Hans-Dieter Sues (red.): In the Shadow of the Dinosaurs: Early Mesozoic Tetrapods. Cambridge: Cambridge University Press, 1994, s. 38–69. ISBN 0-521-45242-2.
- ↑ Michael J. Benton. The demise of a living fossil?. „Nature”. 323, s. 762, 1986. DOI: 10.1038/323762b0 (ang.).
- ↑ C. Meloro, M. E.H. Jones. Tooth and cranial disparity in the fossil relatives of Sphenodon (Rhynchocephalia) dispute the persistent 'living fossil' label. „Journal of Evolutionary Biology”. 25 (11), s. 2194–2209, 2012. DOI: 10.1111/j.1420-9101.2012.02595.x (ang.).
- ↑ Jennifer M. Hay, Sankar Subramanian, Craig D. Millar, Elmira Mohandesan, David M. Lambert. Rapid molecular evolution in a living fossil. „Trends in Genetics”. 24 (3), s. 106–109, 2008. DOI: 10.1016/j.tig.2007.12.002 (ang.).
- ↑ a b Jennifer M. Hay, Charles H. Daugherty, Alison Cree, Linda R. Maxson. Low genetic divergence obscures phylogeny among populations of Sphenodon, remnant of an ancient reptile lineage. „Molecular Phylogenetics and Evolution”. 29 (1), s. 1–19, 2003. DOI: 10.1016/S1055-7903(03)00091-5 (ang.).
- ↑ a b c Marc E.H. Jones, Alan J. D. Tennyson, Jennifer P. Worthy, Susan E. Evans, Trevor H. Worthy. A sphenodontine (Rhynchocephalia) from the Miocene of New Zealand and palaeobiogeography of the tuatara (Sphenodon). „Proceedings of the Royal Society B”. 276 (1660), s. 1385–1390, 2009. DOI: 10.1098/rspb.2008.1785 (ang.).
- ↑ Víctor-Hugo Reynoso. A Middle Jurassic Sphenodon-like sphenodontian (Diapsida: Lepidosauria) from Huizachal Canyon, Tamaulipas, Mexico. „Journal of Vertebrate Paleontology”. 16 (2), s. 210–221, 1996. JSTOR: 4523712 (ang.).
- ↑ Oliver Rieppel, Robert R. Reisz. The origin and early evolution of turtles. „Annual Review of Ecology and Systematics”. 30, s. 1–22, 2003. DOI: 10.1146/annurev.ecolsys.30.1.1 (ang.).
- ↑ a b Rafael Zardoya, Alex Meyer. Complete mitochondrial genome suggests diapsid affinities of turtles. „Proceedings of the National Academy of Sciences”. 95 (24), s. 14226–14231, 1998 (ang.).
- ↑ S. Blair Hedges, Laura L. Poling. A molecular phylogeny of reptiles. „Science”. 283 (5404), s. 998–1001, 1999. DOI: 10.1126/science.283.5404.998 (ang.).
- ↑ Michael S.Y. Lee. Molecules, morphology, and the monophyly of diapsid reptiles. „Contributions to Zoology”. 70 (1), s. 1–22, 2001 (ang.).
- ↑ Joshua S. Rest, Jennifer C. Ast, Christopher C. Austin, Peter J. Waddell, Elizabeth A. Tibbetts, Jennifer M. Hay, David P. Mindell. Molecular systematics of primary reptilian lineages and the tuatara mitochondrial genome. „Molecular Phylogenetics and Evolution”. 29 (2), s. 289–297, 2003. DOI: 10.1016/S1055-7903(03)00108-8 (ang.).
- ↑ J.M. Hay, S. D. Sarre, C. H. Daugherty. Nuclear mitochondrial pseudogenes as molecular outgroups for phylogenetically isolated taxa: a case study in Sphenodon. „Heredity”. 93, s. 468–475, 2004. DOI: 10.1038/sj.hdy.6800525 (ang.).
- ↑ a b c Tuatara Facts (ang.). Karori Sanctuary Wildlife Trust. [dostęp 2011-07-16].
- ↑ Sphenodon, Dictionary.com Unabridged (v 1.1) [dostęp 2011-07-16] (ang.).
- ↑ Sphenodon punctatus (GRAY, 1842) (ang.). The Reptile Database. [dostęp 2012-09-02].
- ↑ Tuatara (ang.). BBC – Science & Nature. [dostęp 2011-07-16]. [zarchiwizowane z tego adresu (2005-08-28)].
- ↑ a b c Dick Lutz: Tuatara: A Living Fossil. Salem, Oregon: DIMI PRESS, 2006, s. 16. ISBN 0-931625-43-2.
- ↑ a b Brian Gill, Tony Whitaker: New Zealand Frogs and reptiles. David Bateman publishing, 1996, s. 22–24. ISBN 1-86953-264-3.
- ↑ Walter L. Buller. Notes on the tuatara lizard (Sphenodon punctatum), with a description of a supposed new species. „Transactions and Proceedings of the New Zealand Institute”. 9, s. 317–325, 1877 (ang.).
- ↑ a b Charles H. Daugherty, Alison Cree Jennifer M. Hay, Michael B. Thompson. Neglected taxonomy and continuing extinctions of tuatara (Sphenodon). „Nature”. 347, s. 177–179, 1990. DOI: 10.1038/347177a0 (ang.).
- ↑ Jennifer M. Hay, Stephen D. Sarre, David M. Lambert, Fred W. Allendorf, Charles H. Daugherty. Genetic diversity and taxonomy: a reassessment of species designation in tuatara (Sphenodon: Reptilia). „Conservation Genetics”. 11 (3), s. 1063–1081, 2010. DOI: 10.1007/s10592-009-9952-7 (ang.).
- ↑ William Colenso. Notes on the bones of a species of Sphenodon (S. diversum, Col.,) apparently distinct from the species already known. „Transactions and Proceedings of the Royal Society of New Zealand”. 18, s. 118–128, 1885 (ang.).
- ↑ Mikko Haaramo: Sphenodontida (ang.). Mikko’s Phylogeny Archive. [dostęp 2011-07-16].
- ↑ a b Facts about tuatara (ang.). Department of Conservation. [dostęp 2012-09-02]. [zarchiwizowane z tego adresu (2014-01-12)].
- ↑ Matt Russell. Tuatara, Relics of a Lost Age. „The Desert Monitor”. 29 (1), s. 5, 1998 (ang.).
- ↑ Elliott Jacobson: Infectious diseases and pathology of reptiles. Taylor & Francis, 2007. ISBN 0-8493-2321-5.
- ↑ a b Family Sphenodontidae (Tuataras) (ang.). The Reptile Database. [dostęp 2010-06-19].
- ↑ Reptile: Tuatara (ang.). San Diego Zoo. [dostęp 2011-07-16].
- ↑ a b c Nicola J. Nelson, Susan N. Keall, Shirley Pledger, Charles H. Daugherty. Male-biased sex ratio in a small tuatara population. „Journal of Biogeography”. 29 (5-6), s. 633–640, 2002. DOI: 10.1046/j.1365-2699.2002.00712.x (ang.).
- ↑ Lorenzo Alibardi. Cytology and localization of chromatophores in the skin of the Tuatara (Sphenodon punctaus). „Acta Zoologica”. 93 (3), s. 330–337, 2012. DOI: 10.1111/j.1463-6395.2011.00506.x (ang.).
- ↑ a b Hanna Gucwińska, Antoni Gucwiński: Zwierzęta w zbroi. Wrocław: Wydawnictwo Dolnośląskie, 1995, s. 8. ISBN 83-7023-389-9.
- ↑ Oliver Rieppel, Michael deBraga. Turtle as diapsid reptiles. „Nature”. 384, s. 453–455, 1996. DOI: 10.1038/384453a0 (ang.).
- ↑ a b Vicky Schaerlaeken, Anthony Herrel, Peter Aerts, Callum F. Ross. The functional significance of the lower temporal bar in Sphenodon punctatus. „Journal of Experimental Biology”. 211, s. 3908–3914, 2008. DOI: 10.1242/jeb.021345 (ang.).
- ↑ Mo Jinyou, Xu Xing, Susan E. Evans. The evolution of the lepidosaurian lower temporal bar: new perspectives from the Late Cretaceous of South China. „Proceedings of the Royal Society B: Biological Sciences”. 277 (1679), s. 331–336, 2010. DOI: 10.1098/rspb.2009.0030 (ang.).
- ↑ R. Platel. [Anatomy of the brain of the New Zealand Gray Sphenodon punctatus (Sphenodontidae). A quantitative study of the principle subdivisions of the brain]. „Journal für Hirnforschung”. 30 (3), s. 325–327, 1989. PMID: 2745969 (ang.).
- ↑ a b c Neil Curtis, Marc E.H. Jones, Junfen Shi, Paul O’Higgins, Susan E. Evans, Michael J. Fagan. Functional relationship between skull form and feeding mechanics in Sphenodon, and implications for diapsid skull development. „PLoS ONE”. 6 (12): e29804, 2011. DOI: 10.1371/journal.pone.0029804 (ang.).
- ↑ a b Marc E. H. Jones, A. Kristopher Lappin. Bite-force performance of the last rhynchocephalian (Lepidosauria: Sphenodon). „Journal of the Royal Society of New Zealand”. 39 (3), s. 71–83, 2009. DOI: 10.1080/03014220909510565 (ang.).
- ↑ G. C. Gorniak, H. I. Rosenberg, Carl Gans. Mastication in the tuatara, Sphenodon punctatus (Reptilia: Rhynchocephalia): Structure and activity of the motor system. „Journal of Morphology”. 171 (3), s. 321–353, 1982. DOI: 10.1002/jmor.1051710307 (ang.).
- ↑ a b Kurt Schwenk. Morphology of the tongue in the tuatara, Sphenodon punctatus (Reptilia: Lepidosauria), with comments on function and phylogeny. „Journal of Morphology”. 188 (2), s. 129–156, 1986. DOI: 10.1002/jmor.1051880202 (ang.).
- ↑ Neil Curtis, Marc E.H. Jones, Susan E. Evans, Shi Junfen, Paul O’Higgins, Michael J. Fagan. Predicting muscle activation patterns from motion and anatomy: modelling the skull of Sphenodon (Diapsida: Rhynchocephalia). „Journal of the Royal Society Interface”. 7 (42), s. 153–160, 2010. DOI: 10.1098/rsif.2009.0139 (ang.).
- ↑ a b c d Dick Lutz: Tuatara: A Living Fossil. Salem, Oregon: DIMI PRESS, 2006, s. 27.
- ↑ a b Marc E.H. Jones. Skull shape and feeding strategy in Sphenodon and other Rhynchocephalia (Diapsida: Lepidosauria). „Journal of Morphology”. 269 (8), s. 945–966, 2008. DOI: 10.1002/jmor.10634 (ang.).
- ↑ a b Anthony Herrel, Jennifer A. Moore, Evan M. Bredeweg, Nicola J. Nelson. Sexual dimorphism, body size, bite force and male mating success in tuatara. „Biological Journal of the Linnean Society”. 100 (2), s. 287–292, 2010. DOI: 10.1111/j.1095-8312.2010.01433.x (ang.).
- ↑ a b Leon P.A.M. Claessens. Dinosaur gastralia: origin, morphology, and function. „Journal of Vertebrate Paleontology”. 24 (1), s. 89–106, 2004. DOI: 10.1671/A1116-8 (ang.).
- ↑ a b Jonathan R. Codd, Philip L. Manning, Mark A. Norell, Steven F. Perry. Avian-like breathing mechanics in maniraptoran dinosaurs. „Proceedings of the Royal Society B”. 275 (1631), s. 157–161, 2008. DOI: 10.1098/rspb.2007.1233 (ang.).
- ↑ Bridget Allen: Tuatara. Sphenodon (ang.). University of San Francisco. [dostęp 2017-01-16].
- ↑ Hervé Seligmann, Jiří Moravec, Yehudah L. Werner. Morphological, functional and evolutionary aspects of tail autotomy and regeneration in the 'living fossil' Sphenodon (Reptilia: Rhynchocephalia). „Biological Journal of the Linnean Society”. 93 (4), s. 721–743, 2008. DOI: 10.1111/j.1095-8312.2008.00975.x (ang.).
- ↑ I. R. Schwab, G. R. O’Connor. The lonely eye. „British Journal of Ophthalmology”. 89 (3), s. 256, 2005. DOI: 10.1136/bjo.2004.059105 (ang.).
- ↑ Casey Y.-J. Ung, Anthony C.B. Molteno. An enigmatic eye: the histology of the tuatara pineal complex. „Clinical & Experimental Ophthalmology”. 32 (6), s. 614–618, 2004. DOI: 10.1111/j.1442-9071.2004.00912.x (ang.).
- ↑ Dick Lutz: Tuatara: A Living Fossil. Salem, Oregon: DIMI PRESS, 2006, s. 26.
- ↑ Tim R. Halliday: Salamanders and newts: Finding breeding ponds. W: Tim Halliday, Kraig Adler (red.): The new encyclopedia of reptiles and amphibians. Oxford: Oxford University Press, 2002, s. 52. ISBN 0-19-852507-9.
- ↑ C. Gans, E. G. Wever. Ear and hearing in Sphenodon punctatus. „Proceedings of the National Academy of Sciences”. 73 (11), s. 4244–4246, 1976 (ang.).
- ↑ Melissa Kaplan: Reptile Hearing (ang.). Melissa Kaplan’s Herp Care Collection. [dostęp 2011-07-16].
- ↑ a b James C. Gillingham, Christopher Carmichael, Tracy Miller. Social behavior of the tuatara, Sphenodon punctatus. „Herpetological Monographs”. 9, s. 5–16, 1995. JSTOR: 1466993 (ang.).
- ↑ Tuatara: Facts (ang.). Southland Museum & Art Gallery. [dostęp 2011-07-16].
- ↑ a b Michael B. Thompson, Charles H. Daugherty. Metabolism of Tuatara, Sphenodon punctatus. „Comparative Biochemistry and Physiology – Part A: Molecular & Integrative Physiology”. 119 (2), s. 519–522, 1998. DOI: 10.1016/S1095-6433(97)00459-5 (ang.).
- ↑ Bruce Musico, Sphenodon punctatus, (On-line) Animal Diversity Web [dostęp 2011-07-16] (ang.).
- ↑ a b D. Kim Burnham, Susan N. Keall, Nicola J. Nelson, Charles H. Daugherty. T cell function in tuatara (Sphenodon punctatus). „Comparative Immunology, Microbiology and Infectious Diseases”. 28 (3), s. 213–222, 2005. DOI: 10.1016/j.cimid.2005.01.005 (ang.).
- ↑ Hilary C. Miller, Katherine Belov, Charles H. Daugherty. Characterization of MHC class II genes from an ancient reptile lineage, Sphenodon (tuatara). „Immunogenetics”. 57 (11), s. 883–891, 2005. DOI: 10.1007/s00251-005-0055-4 (ang.).
- ↑ Wang Zhenshan, Tsutomu Miyake, Scott V. Edwards, Chris T. Amemiya. Tuatara (Sphenodon) genomics: BAC library construction, sequence survey, and application to the DMRT gene family. „Journal of Heredity”. 97 (6), s. 541–548, 2006. DOI: 10.1093/jhered/esl040 (ang.).
- ↑ a b D. O’Meally, H. Miller, H.R. Patel, J.A. Marshall Graves, T. Ezaz. The first cytogenetic map of the tuatara, Sphenodon punctatus. „Cytogenetic and Genome Research”. 129 (2-4), s. 213–223, 2009. DOI: 10.1159/000300099 (ang.).
- ↑ Craig B. Lowe, Gill Bejerano, Sofie R. Salama, David Haussler. Endangered species hold clues to human evolution. „Journal of Heredity”. 101 (4), s. 437–447, 2010. DOI: 10.1093/jhered/esq016. PMID: 20332163 (ang.).
- ↑ T. B. Norris, G. K. Rickards, C. H. Daugherty. Chromosomes of tuatara, Sphenodon, a chromosome heteromorphism and an archaic reptilian karyotype. „Animal Cytogenetics and Comparative Mapping”. 105 (1), s. 93–99, 2004. DOI: 10.1159/000078014 (ang.).
- ↑ a b D. Kim Burnham, Susan N. Keall, Nicola J. Nelson, Charles H. Daugherty. Effects of sampling date, gender, and tick burden on peripheral blood cells of captive and wild tuatara (Sphenodon punctatus). „New Zealand Journal of Zoology”. 33 (4), s. 241–248, 2006. DOI: 10.1080/03014223.2006.9518453 (ang.).
- ↑ Donald G. Newman. Burrow use and population densities of tuatara (Sphenodon punctatus) and how they are influenced by fairy prions (Pachyptila turtur) on Stephens Island, New Zealand. „Herpetologica”. 43 (3), s. 336–344, 1987. JSTOR: 3892500 (ang.).
- ↑ G. Y. Walls. Feeding ecology of the tuatara Sphenodon punctatus on Stephens Island, Cook Strait. „New Zealand Journal of Ecology”. 4, s. 89–97, 1981 (ang.). [dostęp 2016-03-05].
- ↑ A.A. Besson, A. Thierry, E. Boros, K. Allen, S. Bradley, C. Norrie, A. Cree. Evidence of food chemical discrimination in tuatara (o. Rhynchocephalia): comparison with a gekkotan lizard (o. Squamata). „Journal of Herpetology”. 43 (1), s. 124–131, 2009. DOI: 10.1670/08-164R.1 (ang.).
- ↑ Charles Daugherty, Susan Keall: Tuatara – Life history (ang.). Te Ara Encyclopedia of New Zealand. [dostęp 2011-07-16].
- ↑ Tuatara diary (ang.). Southland Museum and Art Gallery. [dostęp 2011-07-16].
- ↑ a b J. Castanet, D. G. Newman, H. Saint Girons. Skeletochronological data on the growth, age, and population structure of the tuatara, Sphenodon punctatus, on Stephens and Lady Alice Islands, New Zealand. „Herpetologica”. 44 (1), s. 25–37, 1988. JSTOR: 3892195 (ang.).
- ↑ a b Alison Cree, J.F. Cockrem, L. J. Guillette Jr. Reproductive cycles of male and female tuatara (Sphenodon punctatus) on Stephens Island, New Zealand. „Journal of Zoology”. 226 (2), s. 199–217, 1992. DOI: 10.1111/j.1469-7998.1992.tb03834.x (ang.).
- ↑ a b Alison Cree. Low annual reproductive output in female reptiles from New Zealand. „New Zealand Journal of Zoology”. 21 (4), s. 351–372, 1994. DOI: 10.1080/03014223.1994.9518005 (ang.).
- ↑ a b c d e Nicola J. Mitchell, Fred W. Allendorf, Susan N. Keall, Charles H. Daugherty, Nicola J. Nelson. Demographic effects of temperature-dependent sex determination: will tuatara survive global warming?. „Global Change Biology”. 16 (1), s. 60–72, 2010. DOI: 10.1111/j.1365-2486.2009.01964.x (ang.).
- ↑ Carl Gans, James C. Gillingham, David L. Clark. Courtship, mating and male combat in Tuatara, Sphenodon punctatus. „Journal of Herpetology”. 18 (2), s. 194–197, 1984. DOI: 10.2307/1563749 (ang.).
- ↑ Jennifer A. Moore, Charles H. Daugherty, Nicola J. Nelson. Large male advantage: phenotypic and genetic correlates of territoriality in tuatara. „Journal of Herpetology”. 43 (4), s. 570–578, 2009. DOI: 10.1670/08-290.1 (ang.).
- ↑ H. Saint Girons, D. G. Newman. The reproductive cycle of the male tuatara, Sphenodon punctatus, on Stephens Island, New Zealand. „New Zealand Journal of Zoology”. 14 (2), s. 231–237, 1987. DOI: 10.1080/03014223.1987.10422993 (ang.).
- ↑ Dick Lutz: Tuatara: A Living Fossil. Salem, Oregon: DIMI PRESS, 2006, s. 19.
- ↑ J.M. Healy, B. G. M. Jamieson. Ultrastructure of the spermatozoon of the tuatara (Sphenodon punctatus) and its relevance to the relationships of the Sphenodontida. „Philosophical Transactions of the Royal Society B”. 335 (1274), s. 193–205, 1992. DOI: 10.1098/rstb.1992.0018 (ang.).
- ↑ Alison Cree, Charles H. Daugherty, Susan F. Schafer, Derek Brown. Nesting and clutch size of tuatara (Sphenodon guntheri) on North Brother Island, Cook Strait. „Tuatara”. 31 (1), s. 9–16, 1991 (ang.).
- ↑ M. B. Thompson, G. C. Packard, M. J. Packard, B. Rose. Analysis of the nest environment of tuatara Sphenodon punctatus. „Journal of Zoology”. 238 (2), s. 239–251, 1996. DOI: 10.1111/j.1469-7998.1996.tb05392.x (ang.).
- ↑ Jeanine M. Refsnider, Susan N. Keall, Charles H. Daugherty, Nicola J. Nelson. Does nest-guarding in female tuatara (Sphenodon punctatus) reduce nest destruction by conspecific females?. „Journal of Herpetology”. 43 (2), s. 294–299, 2009. DOI: 10.1670/08-120R1.1 (ang.).
- ↑ Mary J. Packard, Michael B. Thompson, Kenneth N. Goldie, Marta Vos. Aspects of shell formation in eggs of the tuatara, Sphenodon punctatus. „Journal of Morphology”. 197 (2), s. 147–157, 1988. DOI: 10.1002/jmor.1051970203 (ang.).
- ↑ Donald G. Newman, Peter R. Watson, Ian McFadden. Egg production by tuatara on Lady Alice and Stephens Island, New Zealand. „New Zealand Journal of Zoology”. 21 (4), s. 387–398, 1994. DOI: 10.1080/03014223.1994.9518008 (ang.).
- ↑ Reptile becomes a father, at 111 (ang.). BBC News. [dostęp 2011-07-16].
- ↑ Alison Cree, Michael B. Thompson, Charles H. Daugherty. Tuatara sex determination. „Nature”. 375, s. 573, 1995. DOI: 10.1038/375543a0 (ang.).
- ↑ Nicola J. Mitchell, Nicola J. Nelson, Alison Cree, Shirley Pledger, Susan N. Keall, Charles H. Daugherty. Support for a rare pattern of temperature-dependent sex determination in archaic reptiles: evidence from two species of tuatara (Sphenodon). „Frontiers in Zoology”. 3: 9, 2006. DOI: 10.1186/1742-9994-3-9 (ang.).
- ↑ Michael B. Thompson. Incubation of eggs of tuatara, Sphenodon punctatus. „Journal of Zoology”. 222 (2), s. 303–318, 1990. DOI: 10.1111/j.1469-7998.1990.tb05679.x (ang.).
- ↑ Nicola J. Nelson, Michael B. Thompson, Shirley Pledger, Susan N. Keall, Charles H. Daugherty. Egg mass determines hatchling size, and incubation temperature influences post-hatching growth, of tuatara Sphenodon punctatus. „Journal of Zoology”. 263 (1), s. 77–87, 2004. DOI: 10.1017/S095283690400490X (ang.).
- ↑ Christine Mlot. Return of the tuatara: A relict from the age of dinosaurs gets a human assist. „Science News”. 152 (19), s. 300–301, 1997. JSTOR: 3980976 (ang.).
- ↑ a b c d Peter Gaze: Tuatara recovery plan 2001–2011. W: Threatened Species Recovery Plan 47. Wellington: Biodiversity Recovery Unit, Department of Conservation, Government of New Zealand, 2001, s. 1–36. ISBN 0-478-22131-2.
- ↑ Dick Lutz: Tuatara: A Living Fossil. Salem, Oregon: DIMI PRESS, 2006, s. 59–60.
- ↑ Ian G. Crook. The tuatara, Sphenodon punctatus Gray, on islands with and without populations of the Polynesian rat, Rattus exulans (Peale). „Proceedings of the New Zealand Ecological Society”. 20, s. 115–120, 1973 (ang.). [dostęp 2016-03-05].
- ↑ a b Alison Cree, Charles H. Daugherty, Jennifer M. Hay. Reproduction of a rare New Zealand reptile, the tuatara Sphenodon punctatus, on rat-free and rat-inhabited islands. „Conservation Biology”. 9 (2), s. 373–383, 1995. DOI: 10.1046/j.1523-1739.1995.9020373.x (ang.).
- ↑ Claudine L. Tyrrell, Alison Cree, David R. Towns: Variation in reproduction and condition of northern tuatara (Sphenodon punctatus punctatus) in the presence and absence of kiore. Wellington: Department of Conservation, 2000, s. 1–42. ISBN 0-478-21963-6. (ang.)
- ↑ Donald G. Newman. Evidence of predation on a young tuatara, Sphenodon punctatus, by kiore, Rattus exulans on Lady Alice Island. „New Zealand Journal of Zoology”. 15 (3), s. 443–446, 1988. DOI: 10.1080/03014223.1988.10422973 (ang.).
- ↑ T. A. Blair, A. Cree, C. M. Skeaff. Plasma fatty acids, triacylglycerol and cholesterol of the tuatara (Sphenodon punctatus punctatus) from islands differing in the presence of rats and the abundance of seabirds. „Journal of Zoology”. 252 (4), s. 463–472, 2000. DOI: 10.1111/j.1469-7998.2000.tb01229.x (ang.).
- ↑ a b Nicola J. Mitchell, Michael R. Kearney, Nicola J. Nelson, Warren P. Porter. Predicting the fate of a living fossil: how will global warming affect sex determination and hatching phenology in tuatara?. „Proceedings of the Royal Society B”. 275 (1648), s. 2185–2193, 2008. DOI: 10.1098/rspb.2008.0438 (ang.).
- ↑ Charles Daugherty, Susan Keall: Tuatara Islands (ang.). Te Ara Encyclopedia of New Zealand. [dostęp 2011-07-16].
- ↑ a b RA Hitchmough, JM Hoare, H Jamieson, D Newman, MD Tocher, PJ Anderson, M Lettinkc, AH Whitaker. Conservation status of New Zealand reptiles, 2009. „New Zealand Journal of Zoology”. 37 (3), s. 203–224, 2010. DOI: 10.1080/03014223.2010.496487 (ang.).
- ↑ R. Hitchmough, Sphenodon punctatus, [w:] The IUCN Red List of Threatened Species [online] [dostęp 2012-09-02] (ang.).
- ↑ Sphenodon guntheri, [w:] The IUCN Red List of Threatened Species [online] [dostęp 2012-09-02] [zarchiwizowane z adresu 2018-03-12] (ang.).
- ↑ Tuatara to be released on Little Barrier Island (ang.). The official website of New Zealand Government. [dostęp 2012-09-02].
- ↑ Rare tuatara raised at Wellington Zoo (ang.). Scoop. [dostęp 2011-07-16].
- ↑ Kimberly A. Miller, Hilary C. Miller, Jennifer A. Moore, Nicola J. Mitchell, Alison Cree, Fred W. Allendorf, Stephen D. Sarre, Susan N. Keall, Nicola J. Nelson. Securing the demographic and genetic future of tuatara through assisted colonization. „Conservation Biology”. 26 (5), s. 790–798, 2012. DOI: 10.1111/j.1523-1739.2012.01902.x (ang.).
- ↑ 130 tuatara find sanctuary (ang.). The Dominion Post. [dostęp 2011-07-16].
- ↑ Ray Lilley: Rare reptile found first time in 200 years (ang.). MSNBC. [dostęp 2011-07-16].
- ↑ James C. Gillingham, Tracy J. Miller. Reproductive ethology of the Tuatara: Sphenodon punctatus: applications in captive breeding. „International Zoo Yearbook”. 30 (1), s. 157–164, 1991. DOI: 10.1111/j.1748-1090.1991.tb03479.x (ang.).
- ↑ Doug Gross: 110-year-old 'living fossil' becomes a dad (ang.). CNN.com. [dostęp 2011-07-16].
- ↑ David Williams: Traditional Kaitiakitanga Rights and Responsibilities. W: Wai 262 Report: Matauranga Maori and Taonga. Waitangi Tribunal, 2001, s. 97–147. ISBN 0-908810-53-9.
- ↑ Kristina M. Ramstad, N. J. Nelson, G. Paine, D. Beech, A. Paul, P. Paul, F. W. Allendorf, C. H. Daugherty. Species and cultural conservation in New Zealand: Maori traditional ecological knowledge of tuatara. „Conservation Biology”. 21 (2), s. 455–464, 2007. DOI: 10.1111/j.1523-1739.2006.00620.x (ang.).
- ↑ Dick Lutz: Tuatara: A Living Fossil. Salem, Oregon: DIMI PRESS, 2006, s. 64.
- ↑ Dennis G. Rainey: Tuatara Graces the Coins of New Zealand (ang.). NumisMaster. [dostęp 2011-07-16]. [zarchiwizowane z tego adresu (4 marca 2016)].
- ↑ Funt nowozelandzki i pens były używane w Nowej Zelandii do 1967 roku, kiedy to walutę zmieniono na dolar nowozelandzki.
- ↑ Pictorials (ang.). New Zealand Post. [dostęp 2011-07-16].
- ↑ 1991 – Tuatara (ang.). New Zealand Post. [dostęp 2011-07-16].
- ↑ 2007 – New Zealand Native Wildlife (ang.). New Zealand Post. [dostęp 2011-07-16].
- ↑ Tuatara: Journal of the Biological Society (ang.). New Zealand Electronic Text Centre. [dostęp 2011-07-16].
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
Zasięg obecnego występowania (kolor czarny). Okręgi oznaczają S. punctatus, a kwadraty - S. guntheri.
Tuatara in Invercargill (New Zealand). His name is Henry.
Size comparison of tuatara and human.
Autor: Benchill, Licencja: CC BY 3.0
Cladogram of relationships of extant Sauria based on en:Image:Tuatara_cladogram.gif by w:user:Samsara. Numbered items are:
- Tuatara
- Lizards
- Snakes
- Crocodiles
- Birds
Autor: User:Sarefo, User:Samsara, Licencja: CC BY 2.5
World distribution of Order Rhynchocephalia, after data from Cogger, H.G & Zweifel, R.G. (1998). Reptiles & Amphibians". ISBN 0121785602
Autor: KeresH, Licencja: CC BY 3.0
Henry, the world's oldest Tuatara in captivity at Invercargill, New Zealand
Autor: ArthurWeasley, Licencja: CC BY 2.5
A schematic of the skull of the tuatara (Sphenodon), based on [1], [2]and [3]. Skull of a tuatara, showing the complete temporal arches, and individual bones:
1 = premaxilla
2 = nasal
3 = prefrontal
4 = frontal
5 = maxilla
6 = postfrontal
7 = dentary
8 = postorbital
9 = jugal
10 = parietal
11 = squamosal
12 = quadratojugal and quadrateAutor: Rich Childs, Licencja: CC BY 2.0
A marked tuatara at Karori Wildlife Sanctuary.
Tuatara