Hemoglobina
| Ten artykuł od 2010-01 wymaga zweryfikowania podanych informacji. |
Hemoglobina (gr. αἷμα haîma "krew"[1], łac. globus "kula"), oznaczana też skrótami Hb lub HGB – czerwony barwnik krwi, białko zawarte w erytrocytach, którego zasadniczą funkcją jest transportowanie tlenu – przyłączanie go w płucach i uwalnianie w tkankach. Mutacje genu hemoglobiny prowadzą do chorób dziedzicznych: anemii sierpowatej, talasemii lub rzadkich chorób zwanych hemoglobinopatiami.
Budowa hemoglobiny
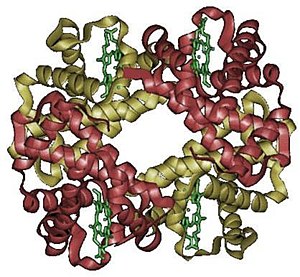
Cząsteczka hemoglobiny jest tetramerem złożonym z dwóch par białkowych podjednostek. Podjednostki oznaczone są najczęściej literami greckiego alfabetu (np. α, β, γ, δ).
| Nazwa hemoglobiny | Pary podjednostek |
|---|---|
| HbA | α2β2 |
| HbF | α2γ2 |
| HbA2 | α2δ2 |
| HbS | α2S2 |
Podjednostki nie są związane kowalencyjnie. Każda podjednostka zawiera jako grupę prostetyczną (niebiałkową) cząsteczkę hemu. Cząsteczka hemu zawiera położony centralnie kation żelaza (Fe2+) umożliwiający jej wiązanie cząsteczek tlenu (O2). Jedna cząsteczka hemoglobiny może przyłączyć od jednej do czterech cząsteczek tlenu, co powoduje, że hemoglobina może występować albo w stanie "odtlenowanym" (deoxyHb) lub w różnym stopniu "utlenowania" (oxyHb). Hem nadaje białku (i krwi) czerwony kolor.
Przykładowa hemoglobina zbudowana z 574 reszt aminokwasowych ma masę cząsteczkową ok. 66,5 kDa, a jej wzór sumaryczny to C3032H4816O872N780S8Fe4[2].
Konformacja łańcuchów α i β ludzkiej hemoglobiny wykazuje podobieństwa do cząsteczki mioglobiny.
Podział hemoglobin
Hemoglobiny "prawidłowe"
- HbA (HbA1) (2α2β) – prawidłowa hemoglobina dorosłych
- HbA2 (2α2δ) – prawidłowa hemoglobina dorosłych; stanowi około 1,5% – 3% hemoglobiny
- HbF (2α2γ) – hemoglobina płodowa; ma większe powinowactwo do tlenu niż HbA, dzięki czemu jest w stanie pobrać tlen z krwi matki przez łożysko i uwolnić go w tkankach płodu. W życiu pozamacicznym jest zastępowana, gdyż słabiej uwalnia tlen w tkankach przy wyższym ciśnieniu parcjalnym tlenu. U dorosłych do 2%
- hemoglobiny embrionalne – mają podobne właściwości jak HbF:
- Hemoglobina Gower 1 (ξ2ε2)
- Hemoglobina Gower 2 (α2ε2)
- Hemoglobina Portland (ξ2γ2)
- HbA1c – HbA z przyłączoną nieenzymatycznie, trwale cząsteczką glukozy do N-końcowych aminokwasów łańcuchów globiny. Duże stężenie świadczy o proporcjonalnie podwyższonej glikemii, co może pozwolić na określenie średniego poziomu glukozy w surowicy przez okres 2-3 miesięcy, a to ma znaczenie np. w ocenie skuteczności leczenia cukrzycy. Norma stanowi 4-6% ogólnej ilości hemoglobiny. Produkty przejściowe pomiędzy HbA1 a HbA1c stanowią formy HbA1a oraz HbA1b będące zasadami Schiffa, w których glukoza jest przyłączona odwracalnie. Ogólna liczba wszystkich form glikowanej hemoglobiny powinna mieścić się w zakresie 6–8% ogólnej ilości hemoglobiny.
Hemoglobiny nieprawidłowe
- HbS – jest efektem mutacji punktowej, w efekcie której następuje podmiana hydrofilowej reszty kwasu glutaminowego w pozycji A2 (6β) na hydrofobową resztę waliny, co powoduje powstanie lepkich miejsc i tworzenia agregatów nieutlenowanej HbS, które zniekształcają erytrocyty prowadząc do niedokrwistości sierpowatokrwinkowej
- HbM – mutacja powodująca zamianę reszty histydyny w pozycji F8 na resztę tyrozyny, która stabilizuje żelazo w hemie w formie Fe3+ zamiast Fe2+. Hemoglobina zawierająca Fe3+ (methemoglobina, metHb) nie wiąże się z tlenem.
- Hemoglobina typu Chesapeake – zamiana Arg na Leu w pozycji FG4 (92 w łańcuchu α)
- Hemoglobina typu Bristol – zmiana Val na Asp w pozycji 67 łańcucha β. Zmiana nie powoduje zaburzenia funkcji
- Hemoglobina typu Sydney – zmiana Val na Ala w pozycji 67 łańcucha β. Zmiana nie powoduje zaburzenia funkcji
- Hemoglobina typu Hikari – zmiana Lys na Asn w pozycji 61 łańcucha β. Zmiana nie powoduje zaburzenia funkcji
- Hemoglobina typu Milwaukee – zmiana Val na Glu w pozycji 67 łańcucha β. Zmiana nie powoduje zaburzenia funkcji
- Hemoglobina typu Lepore – (2α2Lepore) – hemoglobina w jednym z typów β-talasemii, wynik delecji genów kodujących łańcuchy β i δ. Ich resztki tworzą gen kodujący łańcuch Lepore.
Uwaga: litery greckie w nawiasach oznaczają jakie łańcuchy globiny wchodzą w skład cząsteczki.
Zmiany konformacji pod wpływem tlenu
Przyłączenie cząstki tlenu do jednej z czterech cząstek hemu hemoglobiny powoduje zmianę struktury drugo-, trzecio- i czwartorzędowej całego tetrameru. Przyczyną jest wsunięcie atomu żelaza (położonego w przypadku nieutlenowanej hemoglobiny w odległości około 0,06 nm od płaszczyzny hemu) w płaszczyznę pierścienia hemu po połączeniu z tlenem.
Wsunięcie atomu żelaza pociąga związaną z nim tzw. histydynę proksymalną leżącą w pozycji F8, co powoduje przemieszczenie sąsiednich aminokwasów globiny. Doprowadza to w rezultacie do pęknięcia wiązań poprzecznych pomiędzy końcami karboksylowymi wszystkich czterech cząstek globiny. W efekcie dochodzi do rotacji pary α1/β1 względem pary α2/β2 o 15°.
Przyłączenie cząsteczki tlenu do hemoglobiny ułatwia przyłączanie następnych cząsteczek (tzw. wiązanie kooperacyjne), zaś odczepienie każdej cząstki tlenu ułatwia uwalnianie kolejnych cząsteczek O2. Wiązanie kooperacyjne sprzyja maksymalizacji wysycania tlenem hemoglobiny w płucach (przy danym ciśnieniu parcjalnym tlenu – PO2) oraz oddawania przez nią tlenu w tkankach.
Wiązanie dwutlenku węgla
Hemoglobina transportuje około 15% z ogólnej ilości CO2 przenoszonego przez krew. W momencie gdy z cząstki hemoglobiny zostaje uwolniony tlen, dwutlenek węgla wchodzi w reakcję z grupą α-aminową globiny, tworząc karbaminian, jednocześnie w wyniku tej reakcji powstają wolne protony równoważące protony zużywane w płucach przez efekt Bohra (dwa mole protonów na każdy mol CO2). W wyniku powstania karbaminianu zmienia się ładunek grup na końcach łańcuchów globiny, co umożliwia tworzenie wiązań poprzecznych i przejście do stanu T.
W płucach natomiast, w momencie gdy dochodzi do przejścia ze stanu T do stanu R, w wyniku rozerwania wiązań poprzecznych uwolnione zostają protony z atomów azotu pierścieni imidazolowych histydyny znajdującej się w pozycji HC3 (His 146) na łańcuchach β. Łączą się one z wodorowęglanami, co prowadzi do powstania kwasu węglowego, rozkładanego następnie przez anhydrazę węglanową zawartą w erytrocytach na wodę i dwutlenek węgla usuwany z krążenia.
W tkankach występuje niższe pH niż w płucach, w związku z czym protony wiążą się z histydyną HC3, sprzyjając przejściu hemoglobiny ze stanu R do stanu T.
Rola bisfosfoglicerynianu
W warunkach niedotlenienia w organizmie zwiększa się synteza 2,3-bisfosfoglicerynianu (BPG). Substancja ta, powstająca z 1,3-bisfosfoglicerynianu będącego produktem pośrednim glikolizy, ma właściwość wiązania się z tetramerem hemoglobiny znajdującym się w stanie T i stabilizowania go.
W stanie T konformacja łańcuchów hemoglobiny umożliwia wniknięcie między nie jednej cząstki BPG, która następnie wytwarza po trzy (w sumie sześć) wiązania poprzeczne z każdym z łańcuchów β, a dokładniej z posiadającymi dodatni ładunek resztami waliny w pozycji NA1, lizyny EF6 oraz histydyny H21. Te dodatkowe wiązania utrudniają przejście ze stanu T o niższym powinowactwie do tlenu do stanu R, w którym hemoglobina jest mniej skłonna do uwalniania tlenu.
Ciekawym przystosowaniem ewolucyjnym jest zamiana histydyny H21 na serynę w łańcuchu γ, który zastępuje łańcuch β w hemoglobinie płodowej HbF. Dzięki temu BPG ma mniejszy wpływ na hemoglobinę płodową, a co za tym idzie przy niższym stężeniu tlenu HbF ma do niego większe powinowactwo niż HbA. Efekt ten umożliwia wymianę gazową między krwią płodu a krwią matki zachodzącą w łożysku.
Normy

Normy ilości hemoglobiny we krwi dorosłego człowieka wynoszą około 11,0-17,5 g/dl, jednak ze względu na różne metody pomiarowe każde laboratorium analityczne ustala własne normy (zwykle podyktowane przez producenta analizatora). Ponadto fizjologicznie stężenie hemoglobiny u mężczyzn jest wyższe niż kobiet.
Stężenie hemoglobiny we krwi jest podstawowym kryterium przy diagnozowaniu niedokrwistości. Zmniejszone stężenie występuje również w stanach przewodnienia i w ciąży, a zwiększone świadczy o czerwienicy[3].
Pochodne hemoglobiny
- oksyhemoglobina
- karbaminohemoglobina
- karboksyhemoglobina
- methemoglobina
- cyjanomethemoglobina
- sulfohemoglobina
Zobacz też
Przypisy
- ↑ hem, [w:] Encyklopedia PWN [online] [dostęp 2019-10-20].
- ↑ Eldra Pearl Solomon, Linda R. Berg, Diana W. Martin, Claude A. Villee: Biologia. Wyd. 1. Warszawa: Multico Oficyna Wydawnicza, 1996, s. 68. ISBN 83-7073-090-6. OCLC 37964610.
- ↑ J. Kabata, B. Ochrem, A. Hellmann, Badania laboratoryjne i morfologiczne, [w:] Piotr Gajewski (red.), Interna Szczeklika, Kraków: Medycyna Praktyczna, Polski Instytut Evidence Based Medicine, 2020, ISBN 978-83-7430-627-0.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor:
M•Komorniczak -talk-, polish wikipedist.
|

| ||
| |||
Krzywa saturacji hemoglobiny (HbA)
Autor:
- Haemoglobin-Ketten.svg: Furfur
- derivative work: M•Komorniczak -talk-
| To zdjęcie było poddane obróbce cyfrowej i może różnić się od wersji oryginalnej. Zmiany: Translation to polish. Oryginał można obejrzeć tu: Haemoglobin-Ketten.svg:
|
Miejsce i odsetek syntezy łańcuchów hemoglobiny w życiu pre- i postnatalnym
Autor: Photographer: Julian Voss-Andreae, Licencja: CC-BY-SA-3.0
Sculpture "Heart of Steel (Hemoglobin)", 2005, Weathering steel and glass, height: 5’ (1.60 m), location until Fall 2007: 1st Street/"A" Avenue, City of Lake Oswego.
Autor:
M•Komorniczak -talk-, polish wikipedisyjmnmt.
|

| ||
| |||
Krzywa saturacji hemoglobiny dorosłych(HbA), płodowej (HbF), Mioglobiny(Mb)