Hydroksylaza fenyloalaninowa
Hydroksylaza fenyloalaninowa (4-monooksygenaza fenyloalaninowa, EC 1.14.16.1[1]) – enzym z grupy hydroksylaz, katalizujący przekształcenie L-fenyloalaniny w L-tyrozynę.
Reakcja
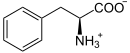
Hydroksylaza fenyloalaninowa katalizuje reakcję addycji grupy hydroksylowej do węgla w pozycji 4 (para) aromatycznego pierścienia fenyloalaniny. Pozostałymi substratami do tej reakcji są tlen i tetrahydrobiopteryna (BH4). Produktami są tyrozyna oraz hydroksytetrahydrobiopteryna (BH4 -4a-karbinoloamina)[2]. Do reakcji niezbędna jest obecność jonów żelaza jako kofaktora.
- (L-fenyloalanina + BH4 + O2 ⇌ L-tyrozyna + BH4-4a-karbinoloamina)
Powstająca BH4-4a-karbinoloamina (4a-hydroksytetrahydrobiopteryna) jest regenerowana do BH4 (tetrahydrobiopteryny) w wyniku działania kolejnych dwóch enzymów, dehydratazy 4a-hydroksytetrahydrobiopteryny (EC 4.2.1.96) i reduktazy dihydropterydyny (EC 1.5.1.34).
Struktura

Hydroksylaza fenyloalaninowa jest homotetramerem, tzn. złożona jest z czterech identycznych podjednostek. Każda podjednostka złożona jest z kolei z trzech domen: regulatorowej, katalitycznej oraz odpowiedzialnej za tetrameryzację enzymu (formowanie tetrameru).
- Domena regulatorowa jest zbudowana z około 115 aminokwasów znajdujących się najbliżej końca aminowego podjednostki.
- Domena katalityczna składa się z około 300 aminokwasów, i odpowiedzialna jest za aktywność katalityczną enzymu.
- Domena odpowiedzialna za tetrameryzację tworzona jest przez pozostałe aminokwasy, których układ tworzy formację zwiniętej spirali, która wraz z suwakiem leucynowym utrzymuje strukturę tetrameru.
Enzym ten zawiera 4 atomy żelaza (po jednym na każdą podjednostkę), którego obecność jest krytyczna dla aktywności enzymatycznej.
Mutacje
Mutacje w genie PAH, kodującym ten enzym, są przyczyną choroby genetycznej, fenyloketonurii.
Podobne enzymy
Hydroksylaza fenyloalaninowa jest spokrewniona z dwoma innymi enzymami:
- hydroksylaza tryptofanowa (EC 1.14.16.4), która kontroluje ilość serotoniny w mózgu i układzie pokarmowym
- hydroksylaza tyrozynowa (EC 1.14.16.2), która nadzoruje ilość dopaminy, adrenaliny, i noradrenaliny w mózgu i rdzeniu nadnerczy.
Te trzy enzymy są homologiczne, to znaczy prawdopodobnie kiedyś wyewoluowały z jednego enzymu.
Przypisy
- ↑ Enzyme Nomenclature: EC 1.14.16 With reduced pteridine as one donor, and incorporation of one atom of oxygen. International Union of Biochemistry and Molecular Biology. [dostęp 2011-10-06].
- ↑ Thöny B., Auerbach G., Blau N. Tetrahydrobiopterin biosynthesis, regeneration and functions. „The Biochemical Journal”. 347 Pt 1, s. 1–16, 2000. DOI: 10.1042/bj3470001. PMID: 10727395. PMCID: PMC1220924.
Media użyte na tej stronie
Structure of L-phenylalanine under physiological conditions
I am author, created from PDB 1KW0
Structure of L-tyrosine under physiological conditions
Structure of 4a-hydroxytetrahydrobiopterin
equilibrium arrow
Structure of 5,6,7,8-tetrahydrobiopterin