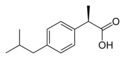
Ibuprofen
| |||||||||||||||||||||||||||||||||||||||||||||||||
 Enancjomery ibuprofenu | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C13H18O2 | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 206,28 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | biały lub prawie biały, krystaliczny proszek lub bezbarwne kryształy[1] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | 15687-27-1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||||||||||||||||||||||||||
| Stosowanie w ciąży | kategoria C | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Ibuprofen (łac. Ibuprofenum) – organiczny związek chemiczny, niesteroidowy lek przeciwzapalny (NLPZ), pochodna kwasu propionowego o działaniu przeciwzapalnym, przeciwbólowym i przeciwgorączkowym.
Zmniejsza obrzęk, poprawia ruchomość stawów i usuwa uczucie zdrętwienia w stawach. Hamuje agregację płytek krwi, zmniejsza krzepliwość krwi. Działanie przeciwbólowe występuje po około 30 minutach i utrzymuje się przez 4 do 6 godzin. Ibuprofen jest wydalany z moczem w 60–90% w postaci metabolitów. Nie kumuluje się w organizmie. U noworodków urodzonych przed 34 tygodniem ciąży stosowany we wlewie dożylnym w celu zamknięcia przetrwałego przewodu tętniczego.
Historia
Ibuprofen opracowany został przez firmę Boots, brytyjskiego producenta leków, w początkach lat 60. XX wieku. Pracownicy Boots odkryli, że właściwości przeciwzapalne kwasu acetylosalicylowego były związane z obecnością grupy kwasu karboksylowego. Po przetestowaniu 6 tysięcy innych kwasów karboksylowych, które miały spełniać podobne funkcje, opracowali substancję początkowo nazwaną Brufen, której działanie przeciwzapalne było dwukrotnie silniejsze od kwasu acetylosalicylowego jako substancji referencyjnej.
W roku 1974 licencję na ibuprofen uzyskała amerykańska firma Upjohn, z zamiarem wyprodukowania leku opartego na substancji (pierwszy opracowany przez Upjohn lek nosił nazwę handlową Motrin). Ochrona patentowa substancji wygasła w roku 1985, co spowodowało wprowadzenie na rynek leków generycznych[6].
Synteza
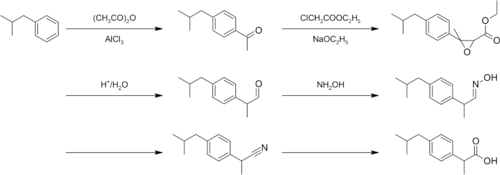
Oryginalny proces syntezy ibuprofenu opracowany w firmie Boots składa się z 6 etapów. Związkiem wyjściowym jest izobutylobenzen, który po acetylowaniu metodą Friedela-Craftsa daje keton p-izobutylofenylowo–metylowy. Z tego związku, w reakcji Darzensa z chlorooctanem etylu, otrzymuje się α,β-epoksy ester, z którego w wyniku dekarboksylacji i hydrolizy powstaje aldehyd zawierający o 1 atom węgla więcej niż keton z etapu II. Kolejna reakcja z hydroksyloaminą daje oksym, przekształcany następnie w nitryl, który hydrolizowany jest do końcowego produktu[7]:
Po wygaśnięciu ochrony patentowej ibuprofenu utworzona została firma BHC (obecnie BASF[8]), w której opracowano nową, bardziej ekonomiczną metodę syntezy ibuprofenu. Proces ten składa się z trzech etapów i wykorzystuje się w nim ten sam związek wyjściowy (izobutylobenzen). Wstępne acetylowanie jest także reakcją Friedla-Craftsa, jednak z wykorzystaniem innego katalizatora – bezwodnego fluorowodoru (będącego także rozpuszczalnikiem w tej reakcji[8]) – który w przeciwieństwie do AlCl3 można łatwo odzyskiwać i wykorzystywać wielokrotnie (AlCl3 w trakcie reakcji ulega hydrolizie i jest usuwany jako odpad)[7]. Powstały keton jest uwodorniany katalitycznie na niklu Raneya do alkoholu, który poddaje się karbonylowaniu na katalizatorze palladowym, uzyskując produkt końcowy[7]:
Optymalizacja syntezy ibuprofenu jest przykładem tzw. zielonej chemii. Znacząco zredukowana została ilość odpadów (z 60% teoretycznej masy substratów do 23%), a biorąc pod uwagę wykorzystanie powstającego kwasu octowego (jedynego produktu ubocznego), wydajność materiałowa sięga 99%. Ponadto wszystkie etapy przebiegają wobec katalizatorów wielokrotnego użytku. Proces ten w roku 1997 został nagrodzony wyróżnieniem Greener Synthetic Pathways Award[8].
Działanie
Działanie leku polega głównie na hamowaniu cyklooksygenaz: (1) konstytutywnej (COX-1) odpowiedzialnej za syntezę prostaglandyn spełniających funkcje fizjologiczne w przewodzie pokarmowym i nerkach; (2) indukowanej (COX-2) odpowiedzialnej za syntezę prostaglandyn prozapalnych w miejscu zapalenia. Z przewodu pokarmowego wchłania się bardzo szybko, częściowo w żołądku i w większym stopniu w jelicie cienkim. Maksymalne stężenie w osoczu osiąga 1–2 h po podaniu tabletki, a 1 h po podaniu zawiesiny. Metabolizm zachodzi w wątrobie. Biologiczny okres półtrwania we krwi wynosi około 2 godzin. W 90% wiąże się z białkami osocza. Wydala się z moczem w postaci 2 nieczynnych metabolitów. Eliminowany całkowicie z krwi w ciągu 24 h od podania ostatniej dawki. Hamuje agregację płytek krwi (słabiej i krócej niż kwas acetylosalicylowy)[9].
Stereochemia
Ibuprofen posiada chiralny atom węgla w pozycji α reszty propionianowej. Występuje więc w dwóch formach enancjomerycznych, mogących różnić się znacząco właściwościami farmakokinetycznymi i metabolizmem. Stwierdzono, że formą aktywną zarówno in vitro, jak i in vivo jest (S)-(+)-ibuprofen (deksibuprofen). Sugerować to mogło, że dla polepszenia selektywności i skuteczności leku korzystne powinno być stosowanie tylko aktywnego enancjomeru zamiast mieszaniny racemicznej (tak jak w spokrewnionym strukturalnie naproksenie).
Dalsze badania in vivo wykazały jednak istnienie w organizmach ssaków izomerazy (epimerazy 2-arylopropionylo-CoA), przekształcającej (R)-ibuprofen w aktywny enancjomer (S)[10][11]. Z tej przyczyny oraz ze względu na kosztowny proces uzyskiwania czystego enancjomeru S, większość preparatów handlowych zawiera oba enancjomery.
 |  |
 |  |
Wskazania
Jako lek przeciwbólowy (łagodne i średnie bóle) i przeciwzapalny w reumatoidalnym zapaleniu stawów, chorobie zwyrodnieniowej stawów obwodowych i kręgosłupa oraz innych chorobach reumatycznych. Również w leczeniu zmian pourazowych, przeciążeniowych i zapalnych tkanek okołostawowych: ścięgien, więzadeł, mięśni, torebek stawowych, kaletek maziowych i pochewek ścięgnistych. Także w innych stanach bólowych (m.in. bóle głowy, zębów, miesiączkowe) oraz w gorączce[9].
Przeciwwskazania
Nadwrażliwość na ibuprofen i inne niesteroidowe leki przeciwzapalne, czynna choroba wrzodowa żołądka i dwunastnicy, skaza krwotoczna. Ostrożnie w astmie oskrzelowej, niewydolności nerek, wątroby i serca oraz u dzieci poniżej 12 roku życia[9].
Interakcje
Jeśli równocześnie stosuje się doustnie leki przeciwzakrzepowe z grupy kumaryn, mogą wystąpić krwawienia. Zwiększa toksyczność metotreksatu, zmniejsza działanie leków moczopędnych, zwiększa stężenie litu i digoksyny. W razie równoczesnego stosowania kortykosteroidów zwiększa się ryzyko działań niepożądanych w przewodzie pokarmowym, włącznie z krwawieniami. Antagonisty receptora H2 zmniejszają działanie leku. Probenecyd i sulfinpirazon przedłużają działanie ibuprofenu. Alkohol nasila działanie leku. Łączne podawanie z innymi NLPZ może wywołać alergię krzyżową.
Działania niepożądane
Ogólne: odbijanie, niestrawność, nudności, bóle w nadbrzuszu, wzdęcia, biegunka, zaparcie, brak łaknienia, rzadziej wrzód żołądka lub dwunastnicy, krwawienie z przewodu pokarmowego[9];
Odczyny alergiczne: skórne reakcje uczuleniowe, rumień, obrzęki, osutka, pokrzywka, nieżyt nosa, astma oskrzelowa: w razie dużych dawek bóle i zawroty głowy, osłabienie, zmęczenie, zatrzymanie płynów, obrzęki, zaburzenia widzenia, senność, upośledzenie czynności nerek; rzadko w długotrwałym leczeniu może wystąpić niedokrwistość hemolityczna, granucytopenia i małopłytkowość. W przypadku stosowania deksibuprofenu możliwe jest zmniejszenie częstości występowania niektórych działań niepożądanych.
Przedawkowanie
Nie daje typowego obrazu klinicznego. Brak antidotum i leczenia swoistego. W przypadku przedawkowania należy stosować leczenie objawowe oraz płukanie żołądka. Nie zaleca się wywoływania wymiotów[12]. Ostre przedawkowanie ibuprofenu wiąże się ze znacznie mniejszym ryzykiem hepatotoksyczności niż w przypadku paracetamolu, ale z drugiej strony z większym ryzykiem krwawienia z układu pokarmowego[13]. Rzadko występują: napady drgawkowe, kwasica metaboliczna, hiperkaliemia, niedociśnienie, bradykardia, tachykardia, migotanie przedsionków, śpiączka, ostra niewydolność nerek, sinica, depresja oddechowa i zatrzymanie krążenia[14]. Ponieważ niektóre niesteroidowe leki przeciwgorączkowe i przeciwbólowe dostępne są bez recepty (w tym ibuprofen) to poważne działania niepożądane i nieświadome przedawkowanie (np. podczas nasilenia sezonowych infekcji wirusowych) może mieć miejsce i czasem prowadzić do śmierci[15].
Ciąża
- Badania na zwierzętach wykazały działanie teratogenne lub zabójcze dla płodu, ale nie przeprowadzono badań z grupą kontrolną kobiet, lub nie przeprowadzono odpowiednich badań ani na zwierzętach, ani u ludzi
W okresie okołoporodowym – D.
- Istnieją dowody na niekorzystne działanie leku na płód, ale w pewnych sytuacjach klinicznych potencjalne korzyści z jego zastosowania przewyższają ryzyko (np. w stanach zagrażających życiu lub chorobach, w których inne, bezpieczne leki nie mogą być zastosowane lub są nieskuteczne).
Dawkowanie
Indywidualnie w zależności od ciężkości choroby i tolerancji na lek. Podane dawki odnoszą się do ibuprofenu w postaci racematu, w razie stosowania deksibuprofenu powinny być one zmniejszone o 25% (100 mg mieszaniny racemicznej odpowiada 75 mg deksibuprofenu)[9].
Dorośli: W chorobach reumatycznych 200–800 mg 3 razy na dobę. Przeciwbólowo 200–400 mg 4–6 razy na dobę. W bolesnych miesiączkach 400 mg 4 razy na dobę. Maksymalna dawka dobowa bez konsultacji z lekarzem 1,2 g, pod nadzorem medycznym 3,2 g[9].
Dzieci od 6. miesiąca do 12 roku życia: przeciwgorączkowo 5–10 mg/kg masy ciała (w zależności od wyniku pomiaru temperatury), maksymalna dawka dobowa 40 mg/kg masy ciała[9].
Miejscowo: 4–10 cm kremu wcierać w chorobowo zmienione miejsca. W przypadku dużych krwiaków lub skręceń można stosować pod opatrunkiem okluzyjnym[9].
Preparaty na rynku polskim
Większość preparatów dostępna jest bez recepty (z przepisu lekarza wydaje się tylko te refundowane, na przykład Ibuprofen 200 mg, 60 tabletek w opakowaniu[16]).
Preparaty proste
Brufen, Bufenik, Dolgit, Ibalgin, Ibufen, Ibum, Ibumax, Ibupar, Ibuprofen (plus doprecyzowanie, zwykle nazwa producenta), Ibuprom, Iburapid, IbuTeva, Ifenin, Kidofen, MIG, Milifen, Nurofen, Pedea, Pediprofen, Spedifen
Preparaty złożone
- ibuprofen + pseudoefedryna: Acatar Zatoki, Ibum Grip, Ibum Zatoki, Ibuprom Zatoki, Infex Zatoki, Metafen Zatoki, Modafen Extra Grip, Nurofen Zatoki, Rinafen Zatoki
- ibuprofen + fenylefryna: Modafen Grip
- ibuprofen + paracetamol: Kidofen Duo, Metafen, Nurofen Ultima
- ibuprofen + kodeina: Nurofen Plus
- ibuprofen + mentol: Dip Rilif (żel)
- ibuprofen + lewomentol: Ibum (żel)
- ibuprofen + heparynoidy: Ibalgin Sport (krem)
Przypisy
- ↑ a b c d e Farmakopea Polska VIII, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2008, s. 3491, ISBN 978-83-88157-53-0.
- ↑ a b Ibuprofen, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2013-02-24] (ang.).
- ↑ a b Ibuprofen, [w:] DrugBank [online], University of Alberta, DB01050 (ang.).
- ↑ a b Ibuprofen (ang.). The Chemical Database. Wydział Chemii Uniwersytetu w Akronie. [dostęp 2013-02-24].[niewiarygodne źródło?]
- ↑ Ibuprofen (nr I4883) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski.
- ↑ Neil Schlager, Jayne Weisblatt, David E. Newton, (red.): Chemical Compounds. Thomson Gale, 2006, s. 9-13. ISBN 978-1-4144-0150-8.
- ↑ a b c Ibuprofen – a case study in green chemistry. ChemWiki. [dostęp 2012-09-14].
- ↑ a b c Presidential Green Chemistry Challenge: 1997 Greener Synthetic Pathways Award. Environmental Protection Agency. [dostęp 2011-01-07]. [zarchiwizowane z tego adresu (2013-07-27)].
- ↑ a b c d e f g h Ibuprofen (opis profesjonalny). Medycyna Praktyczna. [dostęp 2014-06-13].
- ↑ Tracy TS., Hall SD. Metabolic inversion of (R)-ibuprofen. Epimerization and hydrolysis of ibuprofenyl-coenzyme A. „Drug Metab Dispos”. 20. 2, s. 322-7, 1992. PMID: 1352228.
- ↑ Reichel C., Brugger R., Bang H., Geisslinger G., Brune K. Molecular cloning and expression of a 2-arylpropionyl-coenzyme A epimerase: a key enzyme in the inversion metabolism of ibuprofen. „Mol Pharmacol”. 51. 4, s. 576-82, 1997. PMID: 9106621. Pełny tekst
- ↑ Position paper: Ipecac syrup.. „Journal of toxicology. Clinical toxicology”. 2 (42), s. 133–43, 2004. PMID: 15214617.
- ↑ 08-06whichpainkiller.pub. [dostęp 2009-07-20]. [zarchiwizowane z tego adresu (2009-04-07)].
- ↑ Vale JA., Meredith TJ. Acute poisoning due to non-steroidal anti-inflammatory drugs. Clinical features and management.. „Medical toxicology”. 1 (1). s. 12–31. PMID: 3537613.
- ↑ R Stevenson i inni, Mortality During the Winter Flu Epidemic--Two Cases of Death Associated With Self-Medication, „Scottish Medical Journal”, 2001, DOI: 10.1177/003693300104600307, PMID: 11501327 [dostęp 2020-03-27] (ang.).
- ↑ Wyszukiwarka refundowanych leków, środków spożywczych oraz wyrobów medycznych
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Skeletal formula of the (R)-ibuprofen molecule.
Space-filling model of the ibuprofen molecule, based on neutron diffraction data from N. Shankland, C. C. Wilson, A. J. Florence and P. J. Cox (1997). "Refinement of Ibuprofen at 100K by Single-Crystal Pulsed Neutron Diffraction". Acta Crystallographica Section C 53: 951-954. DOI:10.1107/S0108270197003193.
Skeletal formula of the (S)-ibuprofen molecule.
Ibuprofen ist ein Racemat
Ball-and-stick model of the (R)-ibuprofen molecule, based on neutron diffraction data from N. Shankland, C. C. Wilson, A. J. Florence and P. J. Cox (1997). "Refinement of Ibuprofen at 100K by Single-Crystal Pulsed Neutron Diffraction". Acta Crystallographica Section C 53: 951-954. DOI:10.1107/S0108270197003193.
Ball-and-stick model of the (S)-ibuprofen molecule, based on neutron diffraction data from N. Shankland, C. C. Wilson, A. J. Florence and P. J. Cox (1997). "Refinement of Ibuprofen at 100K by Single-Crystal Pulsed Neutron Diffraction". Acta Crystallographica Section C 53: 951-954. DOI:10.1107/S0108270197003193.
Autor: Derrick Coetzee (User:Dcoetzee), Licencja: CC0
200 mg generic Ibuprofen from Safeway grocery store.
Space-filling model of the (S)-ibuprofen molecule, based on neutron diffraction data from N. Shankland, C. C. Wilson, A. J. Florence and P. J. Cox (1997). "Refinement of Ibuprofen at 100K by Single-Crystal Pulsed Neutron Diffraction". Acta Crystallographica Section C 53: 951-954. DOI:10.1107/S0108270197003193.
The improved, green chemistry synthesis of ibuprofen by BHC Adapted from http://www.rsc.org/education/teachers/learnnet/green/ibuprofen/
The original Boots synthesis of ibuprofen Adapted from http://www.rsc.org/education/teachers/learnnet/green/ibuprofen/