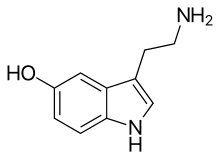
Inhibitory zwrotnego wychwytu serotoniny i noradrenaliny
Inhibitory wychwytu zwrotnego serotoniny i noradrenaliny (ang. serotonin norepinephrine reuptake inhibitor, SNRI) – grupa leków przeciwdepresyjnych hamujących reabsorpcję przez neurony dwóch neuroprzekaźników, serotoniny i noradrenaliny. W efekcie tego zwiększa się ich stężenie w szczelinie synaptycznej pomiędzy neuronami, co skutkuje wzrostem neuroprzekaźnictwa z jednej komórki nerwowej do drugiej[a]. Działanie SNRI jest zbliżone do działania selektywnych inhibitorów zwrotnego wychwytu serotoniny (SSRI).
Wskazania
Leki z tej grupy są wskazane w leczeniu:
- epizodów depresyjnych[1][2]
- zespołu lęku uogólnionego[3][4][5]
- fobii społecznej[6][7]
- zaburzenia lękowego z napadami lęku panicznego[3][8][9]
- zespołu stresu pourazowego[3]
- bólu neuropatycznego[10][11]
- fibromialgii[12]
- przewlekłego bólu mięśniowo-szkieletowego[13]
Oprócz wyżej wymienionych SNRI mogą być stosowane u dorosłych pacjentów z ADHD jako alternatywna dla stymulantów, nie jest to jednak oficjalnie zatwierdzone wskazanie[14].
Mechanizm działania
Serotonina i noradrenalina są neuroprzekaźnikami wydzielanymi przez neurony. Wzrost ich stężenia w szczelinie synaptycznej skutkuje zwiększeniem neuroprzekaźnictwa. Procesem odwrotnym jest wychwyt zwrotny tych neuroprzekaźników przez neurony, co powoduje obniżenie neuroprzekaźnictwa. SNRI działają poprzez inhibicję (hamowanie) drugiego z tych procesów, tj. wychwytu zwrotnego. Konsekwencją jest znaczne zwiększenie stężenia serotoniny oraz noradrenaliny we wszystkich obszarach układu nerwowego, w których występują transportery serotoninowe oraz transportery noradrenaliny. Z punktu widzenia terapii zaburzeń nastroju najistotniejsze jest oddziaływanie leków na mózgowie, a zwłaszcza na
SNRI wpływają także na transmisję dopaminergiczną w korze przedczołowej[15]. Wynika to z tego, że zahamowanie wychwytu zwrotnego noradrenaliny hamuje też wychwyt zwrotny dopaminy w tym obszarze przodomózgowia. Ma to znaczne konsekwencje kliniczne, poprawiając działanie antydepresyjne preparatów z tej grupy.
Zwiększenie stężenia serotoniny oraz noradrenaliny w obwodowym układzie nerwowym jest przyczyną, dla której leki z tej grupy mają także istotne, wykorzystywane klinicznie, działanie przeciwbólowe.
Konsekwencje terapeutyczne
- blokada wychwytu zwrotnego noradrenaliny – leczenie ADHD
- blokada wychwytu zwrotnego noradrenaliny i serotoniny – leczenie bólu neuropatycznego i fibromialgii
- blokada wychwytu zwrotnego noradrenaliny, serotoniny oraz dopaminy – leczenie zaburzeń nastroju, zaburzeń lękowych oraz zaburzeń nerwicowych
Przeciwwskazania[16]
- Nadwrażliwość na stosowany preparat
- Jaskra z wąskim kątem przesączania
- Jednoczasowe podawanie inhibitorów MAO
- Niestabilna choroba wieńcowa
- Przyjmowanie dużej ilości alkoholu
Działania uboczne
Zależne od działania serotoninergicznego
Objawy uboczne zależne od działania serotoninergicznego są zbliżone do działań niepożądanych SSRI. Pobudzenie receptorów serotoninowych 5-HT2A i 5-HT2C w szlaku nerwowym prowadzącym z jądra szwu do ciała migdałowatego i układu limbicznego może wywołać:
- ostre pobudzenie
- lęk
- napady lęku panicznego
Pobudzenie receptorów 5HT2A w zwojach podstawy mózgu może spowodować zahamowanie transmisji dopaminergicznej w tym obszarze, czego efektem może być
- akatyzja
- spowolnienie psychoruchowe
- łagodnie nasilone objawy parkinsonizmu
Pobudzenie receptorów 5HT2A w pniu mózgu może wywołać
Pobudzenie receptorów 5HT2A oraz 5HT2C w rdzeniu kręgowym może zaburzyć odruchy rdzeniowe orgazmu i ejakulacji; pobudzenie receptorów 5HT2A w układzie nagrody prowadzi z kolei do spadku libido prowadząc do
Pobudzenie receptorów 5-HT3 w podwzgórzu oraz w pniu mózgu może prowadzić do
Pobudzenie receptorów 5-HT3 oraz 5-HT4 w układzie pokarmowym może powodować
Zależne od działania noradrenergicznego
Oddziaływanie na receptory noradrenergiczne β1 oraz β2 w móżdżku może wywołać
- pobudzenie ruchowe
- drżenie mięśniowe
Oddziaływanie na transmisję noradrenergiczną w ciele migdałowatym może wywołać
- pobudzenie psychoruchowe
Oddziaływanie na transmisję noradrenergiczną w pniu mózgu może wywołać
- zmiany ciśnienia tętniczego krwi
Oddziaływanie na receptory noradrenergiczne β1 w sercu może wywołać
- zmiany w tętnie
Oddziaływanie na receptory noradrenergiczne w obrębie autonomicznego układu nerwowego może wywołać tak zwany „zespół pseudoantycholinergiczny”, kiedy to nadmierne pobudzenie receptorów noradrenergicznych α1 w układzie współczulnym wywołuje znaczne względne obniżenie napięcia układu przywspółczulnego; efektem może być:
- suchość w ustach
- zaparcie
- retencja moczu
mimo tego, że SSRI nie oddziałują bezpośrednio na receptory muskarynowe
Dynamika działań niepożądanych
U większości pacjentów działania niepożądane pojawiają się w pierwszej dobie leczenia. W trakcie leczenia z reguły stają się coraz łagodniejsze by po około tygodniu terapii ustąpić całkowicie. Niekiedy utrzymują się ze znacznym nasileniem przez cały okres leczenia co jest wskazaniem do przerwania leczenia stosowanym preparatem.
Zatrucia
Zatrucia SNRI są wynikiem celowego działania pacjenta lub efektem interakcji lekowych. Zatrucie lekami z tej grupy jest bardzo niebezpieczne i potencjalnie śmiertelne[17][18]. W wyniku zatrucia SNRI mogą rozwinąć się następujące objawy:
- zaburzenia świadomości od senności do śpiączki włącznie
- zespół serotoninowy
- napady drgawkowe
- zaburzenia ze strony układu krążenia: tachykardia, podwyższone lub obniżone ciśnienie tętnicze krwi
- wymioty (szczególnie niebezpieczne w połączeniu z zaburzeniami świadomości z uwagi na ryzyko zachłyśnięcia)
Preparaty
Leki z grupy SNRI[14]
- wenlafaksyna
- deswenlafaksyna
- milnacipran
- duloksetyna
- klowoksamina
- bicifidyna
- sibutramina[c]
Zobacz też
Uwagi
- ↑ Taki mechanizm działania SNRI (a także SSRI) oznacza, że wywoływany przez nie wzrost stężenia nauroprzekaźników nie jest wynikiem zwiększonego ich wydzielania przez neurony, lecz zmniejszonego wchłaniania (wychwytu zwrotnego).
- ↑ Ten rodzaj zaburzeń występuje również w innych grupach leków np. SSRI.
- ↑ Preparaty zawierające sibutraminę zostały w Polsce wycofane z lekospisów z uwagi na działania toksyczne.
Przypisy
- ↑
 Jean Pierre Olie, David Gourion, Agnes Montagne, Michel Rostin i inni. Milnacipran and venlafaxine at flexible doses (up to 200 mg/day) in the outpatient treatment of adults with moderate-to-severe major depressive disorder: A 24-week randomized, double-blind exploratory study. „Neuropsychiatric Disease and Treatment”. 6 (1), s. 71–79, 2010. DOI: 10.2147/NDT.S10184. PMID: 20396639. PMCID: PMC2854083.
Jean Pierre Olie, David Gourion, Agnes Montagne, Michel Rostin i inni. Milnacipran and venlafaxine at flexible doses (up to 200 mg/day) in the outpatient treatment of adults with moderate-to-severe major depressive disorder: A 24-week randomized, double-blind exploratory study. „Neuropsychiatric Disease and Treatment”. 6 (1), s. 71–79, 2010. DOI: 10.2147/NDT.S10184. PMID: 20396639. PMCID: PMC2854083. - ↑ Michele Mancini i inni, Evaluation of the effect of duloxetine treatment on functioning as measured by the Sheehan disability scale: pooled analysis of data from six randomized, double-blind, placebo-controlled clinical studies, „International Clinical Psychopharmacology”, 6, 27, 2012, s. 298–309, DOI: 10.1097/YIC.0b013e3283589a3f, PMID: 22954893.
- ↑ a b c David S Baldwin. Serotonin noradrenaline reuptake inhibitors: A new generation of treatment for anxiety disorders. „International Journal of Psychiatry in Clinical Practice”. 10 (Suppl2), s. 12–15, 2006. DOI: 10.1080/13651500600637056. PMID: 24921677.
- ↑ Martin A. Katzman, Alex Copeland, Larry Klassen, Pratap Chokka i inni. Pharmacotherapy for generalized anxiety disorder. „Psychiatric Annals”. 41 (2), s. 95–103, 2011. PMID: 12562113.
- ↑ Natalie J. Carter, Paul L. McCormack. Duloxetine: A review of its use in the treatment of generalized anxiety disorder. „CNS Drugs”. 23 (6), s. 523–541, 2009. DOI: 10.2165/00023210-200923060-00006. PMID: 19480470.
- ↑ Venlafaxine and desvenlafaxine. W: Michael E. Thase, Diane M. Sloan, i inni: The American Psychiatric Publishing textbook of psychopharmacology. Wyd. IV. Arlington, VA: American Psychiatric Publishing, Inc, 2009, s. 439–452. (ang.)Sprawdź autora:3.
- ↑ Toshihiko Nagata, Jun Oshima, Akira Wada, Hisashi Yamada i inni. Open trial of milnacipran for Taijin-Kyofusho in Japanese patients with social anxiety disorder. „International Journal of Psychiatry in Clinical Practice”. 7 (2), s. 107–112, 2003. DOI: 10.1080/13651500310000690.
- ↑ R.C. Freire, F. Cosci, A.E. Nardi. Update on pharmacological treatment of panic disorder. „Minerva Psichiatrica”. 52 (3), s. 145–155, 2011.
- ↑
 Donatella Marazziti, Giuseppe Ceraudo, Giorgio Consoli. Effectiveness of duloxetine in a patient suffering from severe panic disorder. „Clinical Neuropsychiatry. Journal of Treatment Evaluation”. 7 (1), s. 15–17, 2010.
Donatella Marazziti, Giuseppe Ceraudo, Giorgio Consoli. Effectiveness of duloxetine in a patient suffering from severe panic disorder. „Clinical Neuropsychiatry. Journal of Treatment Evaluation”. 7 (1), s. 15–17, 2010. - ↑ Harsh Chalana. A case report of milnacipran in phantom-limb pain. „Asian Journal of Psychiatry”. 3 (3), s. 155–156, 2010. DOI: 10.1016/j.ajp.2010.07.009. PMID: 23051576.
- ↑ Kunie Nakajima, Hideaki Obata, Nobuhisa Iriuchijima, Shigeru Saito. An increase in spinal cord noradrenaline is a major contributor to the antihyperalgesic effect of antidepressants after peripheral nerve injury in the rat. „Pain”. 153 (5), s. 990–997, 2012. DOI: 10.1016/j.pain.2012.01.029. PMID: 22424692.
- ↑
 Jay D Kranzler, R. Michael Gendreau. Role and rationale for the use of milnacipran in the management of fibromyalgia. „Neuropsychiatric Disease and Treatment”. 6 (1), s. 197–208, 2010. PMID: 20520784. PMCID: PMC2877602.
Jay D Kranzler, R. Michael Gendreau. Role and rationale for the use of milnacipran in the management of fibromyalgia. „Neuropsychiatric Disease and Treatment”. 6 (1), s. 197–208, 2010. PMID: 20520784. PMCID: PMC2877602. - ↑ Bettahalasoor Somashekar, Ashok Jainer, Balaji Wuntakal. Psychopharmacotherapy of somatic symptoms disorders. „International Review of Psychiatry”. 25 (1), s. 107–115, 2013. DOI: 10.3109/09540261.2012.729758. PMID: 23383672.
- ↑ a b Stephen M. Stahl: Stahl’s Essential Psychopharmacology. Wyd. III. New York: Cambridge University Press, 2009, s. 541–552. ISBN 978-0-521-74609-0. (ang.)
- ↑
 Ciara McCabe, Zevic Mishor. Antidepressant medications reduce subcortical-cortical resting-state functional connectivity in healthy volunteers. „NeuroImage”. 57 (4), s. 1317–1323, 2011. DOI: 10.1016/j.neuroimage.2011.05.051. PMID: 21640839. PMCID: PMC3141109.
Ciara McCabe, Zevic Mishor. Antidepressant medications reduce subcortical-cortical resting-state functional connectivity in healthy volunteers. „NeuroImage”. 57 (4), s. 1317–1323, 2011. DOI: 10.1016/j.neuroimage.2011.05.051. PMID: 21640839. PMCID: PMC3141109. - ↑ Stephen M. Stahl: Podstawy psychofarmakologii. Wyd. I. Gdańsk: VA Media Sp. z o.o., 2008. ISBN 978-83-60945-73-5. (pol.)
- ↑
 Keith Hawton, Helen Bergen, Sue Simkin, Jayne Cooper i inni. Toxicity of antidepressants: Rates of suicide relative to prescribing and non-fatal overdose. „The British Journal of Psychiatry”. 196 (5), s. 354–358, 2010. DOI: 10.1192/bjp.bp.109.070219. PMID: 20435959. PMCID: PMC2862059.
Keith Hawton, Helen Bergen, Sue Simkin, Jayne Cooper i inni. Toxicity of antidepressants: Rates of suicide relative to prescribing and non-fatal overdose. „The British Journal of Psychiatry”. 196 (5), s. 354–358, 2010. DOI: 10.1192/bjp.bp.109.070219. PMID: 20435959. PMCID: PMC2862059. - ↑ Marian Christoph, Bernd Ebner, Dirk Stolte, Karim Ibrahim i inni. Broken heart syndrome: Tako Tsubo cardiomyopathy associated with an overdose of the serotonin-norepinephrine reuptake inhibitor Venlafaxine. „European Neuropsychopharmacology”. 20 (8), s. 594–597, 2010. DOI: 10.1016/j.euroneuro.2010.03.009. PMID: 20451358.
Bibliografia
- Stephen M. Stahl: Stahl’s Essential Psychopharmacology. Wyd. III. New York: Cambridge University Press, 2009, s. 541–552. (ang.)
- David Semple, Roger Smyth: Oxfords handbook of psychiatry. Wyd. II. New York: Oxford University Press, 2009, s. 262. (ang.)
- Jörgen Herlofson, Lisa Ekselius, Lars-Gunnar Lundh, Anders Lundin, i inni: Psykiatri. Wyd. I. Lund: Studentlitteratur AB, 2009, s. 330–333. (szw.)Sprawdź autora:5.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Skeletal formula of serotonin, C10H12N2O.
Structure based on X-ray crystallographic determination from Acta Chem. Scand. (1978) 32a, 267–270.
Structure originally drawn in ChemBioDraw Ultra 12.0 by Ben Mills. It was then manually retraced with Inkscape.Autor: Erik Lundström, Licencja: CC BY-SA 3.0
Prefrontala kortex av hjärnan