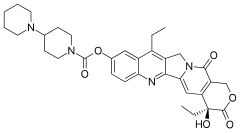
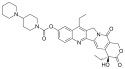
Irynotekan
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||
| Wzór sumaryczny | C33H38N4O6 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 586,68 g/mol | ||||||||||||||||||||||||
| Wygląd | jasnożółty proszek[1] | ||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||
Irynotekan – organiczny związek chemiczny, lek przeciwnowotworowy z grupy inhibitorów topoizomerazy I.
Irynotekan wiąże się z kompleksem składającym się z DNA i topoizomerazy I, przez co zapobiega ponownemu połączeniu nici DNA (religacji) pojedynczego łańcucha. Jest półsyntetycznym analogiem naturalnego alkaloidu kamptotecyny(ang.) uzyskiwanego z drzewa Camptotheca acuminata (dereniowate).
Jest stosowany głównie w chemioterapii raka jelita grubego, w szczególności, w skojarzeniu z innymi chemioterapeutykami. Jest stosowany w schemacie FOLFIRI, na który składa się wlew dożylny 5-fluorouracylu, leukoworyny i irynotekanu. Stosowany również w badaniach klinicznych w przypadkach drobnokomórkowego i niedrobnokomórkowego raka płuca, piersi, wątrobowokomórkowego, jajnika, szyjki macicy, przełyku, żołądka, trzustki[4], nerki, międzybłoniaka oraz nowotworów złośliwych głowy i szyi.
Irynotekan uzyskał przyspieszone zatwierdzenie FDA w 1996 roku[5] i pełną zgodę w 1998 roku[6].
Mechanizm
Irynotekan jest aktywowany poprzez hydrolizę do SN-38, inhibitora topoizomerazy I. Jest on następnie inaktywowany przez glukuronozylotransferazę 1A1 difosforanu urydyny (UGT1A1). Inhibicja topoizomerazy I przez SN-38 prowadzi do zahamowania replikacji i transkrypcji DNA.
Objawy niepożądane
Najistotniejszymi objawami niepożądanymi stosowania leku są ciężkie biegunki oraz silna supresja układu immunologicznego.
Biegunka
Biegunki związane ze stosowaniem irynotekanu są ciężkie i czasami prowadzą do silnego odwodnienia wymagającego hospitalizacji. Leczenie biegunek opiera się na zastosowaniu silnych leków przeciwbiegunkowych, takich jak loperamid lub Lomotil.
Wczesna biegunka (występuje do 24 h po podaniu leku) – towarzyszy jej ostry zespół cholinergiczny (zwężenie źrenic, łzawienie, zaburzenia widzenia, zapalenie spojówek, nieżyt nosa, nasilone wydzielanie śliny, pocenie się, rozszerzenie naczyń krwionośnych, spadek ciśnienia tętniczego, dreszcze, uczucie rozbicia, bóle brzucha).
Immunosupresja
Objawia się znacznym obniżeniem liczby leukocytów, w szczególności neutrofili. Pacjenci mogą doświadczać okresowej neutropenii (znaczne obniżenie liczby neutrofili we krwi) przy jednoczesnym wzroście wytwarzania krwinek białych w szpiku kostnym (mechanizm kompensacyjny).
Przeciwwskazania do zastosowania leku
- nadwrażliwość na którykolwiek składnik preparatu,
- przewlekłe choroby zapalne jelit,
- niedrożność jelita grubego,
- niewydolność szpiku,
- stężenie bilirubiny przekraczające trzykrotnie górną granicę normy.
Farmakogenomika
Irynotekan jest przekształcany enzymatycznie do aktywnego biologicznie metabolitu SN-38 (7-etylo-10-hydroksykamptotecyna). Jest on następnie inaktywowany w wyniku glukuronidacji przez enzym UGT1A1.
Pacjenci z wariantem allelu UGT1A1*28
U osób leczonych irynotekanem z małą aktywnością tego enzymu UGT1A1 metabolit leku SN-38 ulega kumulacji, co może powodować powikłania w postaci ciężkiej biegunki, leukopenii i małopłytkowości. Region promotorowy UGT1A1 w większości populacji zawiera od 5 do 8 powtórzeń TA. Najczęściej występuje 6 powtórzeń. Zaobserwowano zależność pomiędzy liczbą powtórzeń a ekspresją UGT1A1. Siedem powtórzeń odpowiada wariantowi allelu UGT1A1*28. Obecność tego allelu jest związana z obniżoną ekspresją UGT1A1, co powoduje spadek glukuronidacji SN–38 i w konsekwencji zwiększa ryzyko powikłań w postaci leukopenii oraz biegunki[7][8].
W 2005 roku, FDA zmieniła wytyczne podawania irynotekanu u pacjentów homozygotycznych z allelem UGT1A1*28 – zredukowano dawki leku[9]. Irynotekan jest jednym z pierwszych chemioterapeutyków, którego dozowanie jest zależne od genotypu pacjenta[10].
Przypisy
- ↑ Irinotecan, [w:] PubChem [online], United States National Library of Medicine, CID: 60838 (ang.).
- ↑ a b c Irinotecan, [w:] DrugBank [online], University of Alberta, DB00762 (ang.).
- ↑ a b Irinotecan hydrochloride, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2016-04-28] (ang.).
- ↑ Lamb YN, Scott LJ. Liposomal Irinotecan: A Review in Metastatic Pancreatic Adenocarcinoma. „Drugs”, 2017 Apr 11. DOI: 10.1007/s40265-017-0741-1. [dostęp 2017-04-13]. (ang.).
- ↑ New York Times Article http://www.nytimes.com/1996/06/18/science/new-cancer-drug-approved.html.
- ↑ FDA Review Letter http://www.accessdata.fda.gov/drugsatfda_docs/appletter/1998/20571s8ltr.pdf.
- ↑ Innocenti F, Undevia SD, Iyer L, i wsp.. Genetic variants in the UDP-glucuronosyltransferase 1A1 gene predict the risk of severe neutropenia of irinotecan. „J. Clin. Oncol.”. 22 (8), s. 1382–1388, kwiecień 2004. DOI: 10.1200/JCO.2004.07.173. PMID: 15007088.
- ↑ Jong F, Maja J, de Jonge A, i wsp.. Role of pharmacogenetics in irinotecan therapy. „Cancer Lett.”. 234 (1), s. 90–106, marzec 2006. PMID: 16343744.
- ↑ Camptosar® irinotecan hydrochloride injection August 2010 http://labeling.pfizer.com/ShowLabeling.aspx?id=533.
- ↑ O’Dwyer PJ, Catalano RB. Uridine diphosphate glucuronosyltransferase (UGT) 1A1 and irinotecan: practical pharmacogenomics arrives in cancer therapy. „J. Clin. Oncol.”. 24 (28), s. 4534–4538, październik 2006. DOI: 10.1200/JCO.2006.07.3031. PMID: 17008691.
Linki zewnętrzne
- Pfizer website. camptosar.com. [zarchiwizowane z tego adresu (2007-09-29)].
- Irynotekan w bazie leków
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Skeletal formula of irinotecan. Created using ACD/ChemSketch 10.0, Inkscape, and vim.
Picture of a Camptotheca acuminata tree.