Izocyjanian metylu
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C2H3NO | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | CH3NCO | ||||||||||||||||||||||||||||||||
| Masa molowa | 57,5 g/mol | ||||||||||||||||||||||||||||||||
| Wygląd | bezbarwna ciecz | ||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||
Izocyjanian metylu, H
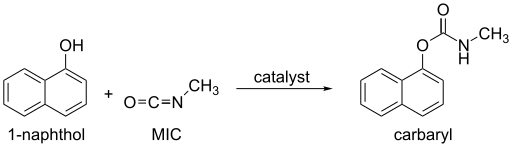
3C−N=C=O – organiczny związek chemiczny, najprostszy możliwy izocyjanian organiczny. Jest półproduktem przy wytwarzaniu pestycydów z grupy karbaminianów (takich jak karbaryl, karbofuran, metomyl czy aldikarb). Używany jest także do produkcji gumy oraz związków adhezyjnych.
Ma własności silnie toksyczne i drażniące. W 1984 r. jego duże ilości zostały uwolnione do atmosfery przez zakłady należące do koncernu Union Carbide w Bhopalu, co spowodowało śmierć ponad 18 000 osób[4][5].
Związek ten został po raz pierwszy otrzymany w 1888 r. z kwasu cyjanowego i metanolu.
Właściwości fizyczne
W temperaturze pokojowej jest bezbarwną cieczą o silnie nieprzyjemnym zapachu. Temperatura wrzenia wynosi 39,1 °C. Jest wysoce łatwopalny, temperatura zapłonu wynosi −7 °C. Jest rozpuszczalny w wodzie w ilości 6-10 części na 100, jednak ulega następnie hydrolizie.
Synteza
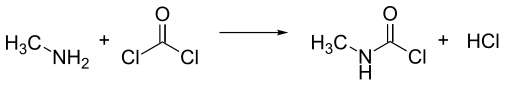
Współcześnie izocyjanian metylu jest produkowany z metyloaminy i fosgenu. Reakcja biegnie w szerokim zakresie temperatur, jednak w produkcji wielkoskalowej syntezuje się go w wysokiej temperaturze w fazie gazowej. Produkty reakcji są następnie chłodzone, w wyniku czego powstały chlorek N-metylokarbaminiowy (MCC, methylcarbamic chloride) ulega kondensacji.
MCC istnieje w równowadze z izocyjanianem metylu.
W celu przesunięcia tej równowagi w prawo, chlorowodór usuwany jest ze środowiska przez przepłukiwanie dowolną zasadą (np. dimetyloanilina, pirymidyna)[6] lub poprzez destylację mieszaniny[7].
Reakcje
MIC reaguje z wieloma substancjami zawierającymi grupy zasadowe, np. N-H lub O-H. Ulega także kondensacji do polimerów zbudowanych z 3 lub większej ilości wyjściowych cząsteczek.
Izocyjanian metylu pod wpływem wody rozkłada się na mocznik oraz dwutlenek węgla z wytworzeniem ciepła (325 cal na gram MIC).
W temp. 25 °C, pod wpływem wody, połowa MIC ulega reakcji w czasie 9 minut[8]. Jeśli wydzielone ciepło nie zostanie odebrane z ośrodka reakcji, tempo reakcji zaczyna wzrastać doprowadzając MIC do wrzenia. Jeżeli MIC znajduje się w przewadze w stosunku do wody, produktem reakcji jest biuret (dimocznik) oraz dwutlenek węgla[9].
Proste związki zawierające wiązanie N−H, takie jak amoniak lub I, II-rzędowe aminy reagują gwałtownie z MIC, tworząc podstawione pochodne mocznika. Inne związki posiadające wiązania N−H, takie jak amidy lub moczniki, reagują z MIC bardzo powoli[10].
Alkohole i fenole, zawierające grupę O−H, reagują powoli z MIC, jednak bieg reakcji może zostać przyspieszony przy zastosowaniu odpowiednich katalizatorów.
Wiele związków jak np. fosfina czy chlorek żelaza i inne związki zawierające metal katalizują powstanie cyklicznego trimeru MIC, z wytworzeniem dużej ilości ciepła. Tworzenie polimerów obserwowane jest przy obecności trilakilowych pochodnych amin. Tworzenie trimerów jest reakcją egzotermiczną (298 cal/g MIC), co może powodować wrzenie mieszaniny reakcyjnej. Z tego też powodu MIC nie powinien być przechowywany w powszechnie stosowanych w przemyśle stalowych zbiornikach[9].
Zagrożenia
Izocyjanian metylu jest związkiem silnie toksycznym. Bezpieczne stężenie w powietrzu według niektórych źródeł to 0,02 ppm. MIC powoduje zaburzenia pracy układu oddechowego przy stężeniu powyżej 0,4 ppm, objawiając się kaszlem, bólem klatki piersiowej, dusznościami, astmą, podrażnieniem oczu, nosa, gardła, a także podrażnieniem skóry. Wyższe stężenia, powyżej 21 ppm mogą powodować obrzęk płuc, wewnętrzne krwotoki, zapalenie płuc oraz śmierć[11].
Efekty toksyczne były obserwowane w czasie katastrofy w Bhopalu, w której uwolniło się do atmosfery 43 000 kg izocyjanianu metylu i innych szkodliwych gazów w silnie zaludnionej strefie 3 grudnia, 1984, zabijając około 20 tys. osób, a u 120 tysięcy powodując różnego typu dolegliwości.
Przypisy
- ↑ a b c d e Methyl isocyanate, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 11520 [dostęp 2013-12-09] (niem. • ang.).
- ↑ methyl isocyanate (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2015-04-07].
- ↑ a b c Methyl isocyanate: Chemical Datasheet, Cameo Chemicals [dostęp 2013-12-09] (ang.).
- ↑ Chronology, Union Carbide Corporation, listopad 2010 [dostęp 2011-10-11] [zarchiwizowane 2012-08-23].
- ↑ E. Broughton, The Bhopal disaster and its aftermath: a review, „Environ Health”, 4 (1), 2005, s. 6, DOI: 10.1186/1476-069X-4-6, PMID: 15882472, PMCID: PMC1142333 (ang.).
- ↑ R.J. Slocombe, E.E. Hardy, Process of Producing Carbamyl Chlorides, patent US 2480088, 23 sierpnia 1949.
- ↑ Merz W, „Procédé et dispositif de préparation d’isocyanates d’alkyle”, French Patent, No. 1,400,863, Farbenfabriken Bayer AG, Germany 1965.
- ↑ Enrique A. Castro, Roy B. Moodie, Peter J. Sansom, The kinetics of hydrolysis of methyl and phenyl lsocyanates, „Journal of the Chemical Society, Perkin Transactions 2”, 5, 1985, s. 737–742, DOI: 10.1039/P29850000737 (ang.).
- ↑ a b Union Carbide Corporation „Methyl Isocyanate” – Product Information Publication, F-41443, November 1967.
- ↑ J. March, Advanced Organic Chemistry, wyd. 3, New York: John Wiley & Sons, 1985, s. 802.
- ↑ G. = Kimmerle, A. Eben, Zur Toxicität von Methylisocyanat und dessen quantitativer Bestimmung in der Luft, „Arch Toxikol”, 20, 1964, s. 235–41, PMID: 14230785 (niem.).
Bibliografia
- „The Bhopal Saga: Causes and Consequences of the Worlds Largest Industrial Disaster”, I. Eckerman, Universities Press India, 2005
Linki zewnętrzne
- NIOSH Safety and Health Topic: Isocyanates, from the website of the National Institute for Occupational Safety and Health (NIOSH)
- http://toxnet.nlm.nih.gov/cgi-bin/sis/search/f?./temp/~JTfkyc:1, Methyl Isocyanate from NLM’s Hazardous Substances Databank
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Autor: Hbf878, Licencja: CC0
Formation of methyl isocyanate (MIC) and hydrochloric acid from N-methylcarbamoyl chloride (MCC).
Reaction of methyl isocyanate with water
drawn by Oldsci with ISIS-drawChemical structure of methyl isocyanate.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Autor: Hbf878, Licencja: CC0
Reaction of methyl isocyanate (MIC) with 1-naphthol to form carbaryl, an aromatic carbamate.
Reaction of Monomethylamine (MMA) and phosgene to form N-methylcarbamoyl chloride (MCC) and hydrochloric acid.