Izomeraza triozofosforanowa
Izomeraza triozofosforanowa, TIM (EC 5.3.1.1) – enzym katalizujący odwracalną reakcję przekształcenia fosfodihydroksyacetonu w D-aldehyd 3-fosfoglicerynowy.
Reakcja
W wyniku przekształcenia fosfodihydroksyacetonu powstaje aldehyd 3-fosfoglicerynowy, który jest wykorzystywany w kolejnym etapie przemiany glukozy w pirogronian (zob. schemat szlaku metabolicznego). Reakcja polega na przeniesieniu atomu wodoru z C-1 na C-2.
Funkcja
Izomeraza triozofosforanowa odgrywa ważną rolę w procesie glikolizy jest niezbędna do wytwarzania energii w komórce. Enzym ten znajduje się w niemal każdym organizmie, wliczając w to zwierzęta takie jak ssaki czy też owady, jak również grzyby, rośliny oraz bakterie. Jednakże istnieją pewne bakterie, które nie przeprowadzają procesu glikolizy, np. bakterie z rodzaju Ureaplasma, u których enzym ten jest nieobecny.
Izomeraza triozofosforanowa jest wysoce skutecznym i wydajnym enzymem. Jego obecność powoduje, że reakcja izomeryzacji fosfodihydroksyacetonu w aldehyd 3-fosfoglicerynowy przebiega około miliarda razy szybciej. Reakcja przeprowadzana przez izomerazę triozofosforanową jest tak wydajna, że uznano ten enzym za katalitycznie perfekcyjny: szybkość reakcji jest ograniczana tylko przez prędkość dyfuzji substratu do miejsca aktywnego.
Mechanizm
W reakcji izomeryzacji uczestniczą dwie reszty katalityczne izomerazy triozofosforanowej – Glu165 oraz His95. Reakcja transformacji polega na przekazywaniu protonu – glutaminian pełni rolę zasady (atak nukleofilowy), a histydyna pełni rolę kwasu – jest donorem protonu (zob. Teoria kwasów i zasad Brønsteda i Lewisa). Produkt pośredni – endiol (zob. diole) – jest zatrzymywany w centrum aktywnym i nie ulega rozpadowi na metyloglioksal i ortofosforan.
Struktura
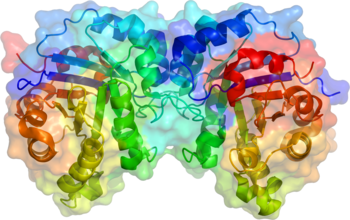
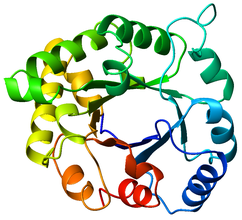
Izomeraza triozofosforanowa jest homodimerem, tzn. jest złożona z dwóch identycznych podjednostek, z których każda zbudowana jest z około 250 reszt aminokwasowych (zob. wiązanie peptydowe i końce łańcucha (N i C) – przykład polipeptydu Val-Gly-Ser-Ala). Struktura trzeciorzędowa podjednostki zawiera 8 alfa-helis na zewnątrz enzymu i 8 harmonijek beta, które tworzą „beczułkę” wewnątrz enzymu. Na ilustracji poniżej zaznaczono kolorami poszczególne końce łańcuchów polipeptydowych – aminowy koniec N (niebieski) i karboksylowy koniec C (czerwony)[a]. Miejsce aktywne tego enzymu tworzą reszty kwasu glutaminowego jak również histydyny. Centrum to znajduje się wewnątrz baryłki. Sekwencja aminokwasów wokół miejsca aktywnego jest silnie zakonserwowana (stabilna) we wszystkich znanych izomerazach triozofosforanowych.
Uwagi
- ↑ Linki zewnętrzne:
– David P. Leader, E. James Milner-White, The structure of the ends of α-helices in globular proteins: Effect of additional hydrogen bonds and implications for helix formation, w: Proteins: Structure, Function, and Bioinformatics Volume 79, Issue 3, pages 1010–1019, March 2011
– Gregg W. Snider, Triose Phosphate Isomerase, Multimedia in Biochemistry and Molecular Biology Education, Vol. 39, No. 6, pp. 464, 2011; Proteopedia Entry
Mutacje
U ludzi, deficyt izomerazy triozofosforanowej jest związany z postępującymi, ciężkimi schorzeniami neurologicznymi, które w większości przypadków prowadzą do śmierci, nawet we wczesnym dzieciństwie.
Zobacz też
Media użyte na tej stronie
Part of the Biochem_reaction_arrow_Y_XXXX_horiz_med.png series for the metabolic pathways wikiproject.
Autor: Oryginalnym przesyłającym był WillowW z angielskiej Wikipedii, Licencja: CC-BY-SA-3.0
Top view of a TIM barrel (PDB accession code 8TIM). Made with MOLMOL.
TPI1 structure
Glycerone-phosphate wpmp
D-glyceraldehyde-3-phosphate wpmp
Autor: Dcrjsr, Licencja: CC BY 3.0
Ribbon schematic (hand drawn & colored) of the 3D structure of the protein triose phosphate isomerase. The barrel of 8 beta strands is shown by green arrows and the 8 alpha-helices as brown spirals. By Jane Richardson. [This white-background version (edited by Lycaon) less historically correct but probably more useful for pure illustration purposes.]