Jon oksoniowy
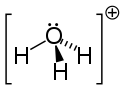
Jony oksoniowe − dowolne indywidua molekularne posiadające trójwiązalny atom tlenu obdarzony ładunkiem dodatnim[1][2]. Najprostszy jon oksoniowy powstający w wyniku protonowania cząsteczki wody to jon hydroniowy[3], który jednocześnie jest definiowany jako związek macierzysty dla podstawionych pochodnych[4]. Znane są również większe agregaty np. kation Zundela i kation Eigena. Inne jony oksoniowe typu RR'C=O(+)H, spotykane często w chemii organicznej, powstają w wyniku protonowania grupy karbonylowej. Analogiczne jony typu RR'C=O(+)−R'' są związkami przejściowymi m.in. w reakcjach hydrolizy kwasowej acetali, ketali i ortoestrów. Jony oksoniowe typu RR'C=O(+)−R'' są stabilizowane rezonansem, w wyniku którego powstaje karbokation RR'C(+)−O−R''[5] (R, R', R'' – dowolna grupa alkilowa lub proton). Podobnie protonowaniu ulegać mogą alkohole oraz etery tworząc jony oksoniowe typu RO(+)H2 i RR'O(+)H[3].
| przykłady jonów oksoniowych | ||||
|---|---|---|---|---|
 |  |  |  | |
| jon hydroniowy | kation Zundela | kation Eigena | protonowany alkohol i eter | protonowana lub alkilowana grupa karbonylowa (R, R', R'' – dowolna grupa alkilowa lub proton) |
Niektóre sole alkoksoniowe są stabilne i znalazły zastosowanie jako czynniki alkilujące. Przykładem jest tetrafluoroboran trimetylooksoniowy (Me3O+)(BF−4) występujący w postaci białego krystalicznego ciała stałego, stosowany jako czynnik metylujący np. w reakcji estryfikacji[6].
Przypisy
- ↑ Jerry March: Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. Wyd. 3. New York: Wiley, 1985. ISBN 0-471-85472-7.
- ↑ J. Clayden, N. Greeves, S. Warren, P. Wothers: Organic Chemistry. Nowy Jork: Oxford University Press, 2007, s. 343–347. ISBN 978-0-19-850346-0.
- ↑ a b Robert T. Morrison, Robert N. Boyd: Chemia Organiczna. T. 1. Warszawa: Wydawnictwo Naukowe PWN, 1997, s. 58–59. ISBN 83-01-04166-8.
- ↑ Oxonium ions, [w:] A.D. McNaught, A. Wilkinson, Compendium of Chemical Terminology (Gold Book), S.J. Chalk (akt.), International Union of Pure and Applied Chemistry, wyd. 2, Oxford: Blackwell Scientific Publications, 1997, DOI: 10.1351/goldbook.O04378, ISBN 0-9678550-9-8 (ang.).
- ↑ George A. Olah, Norihiko Yoneda, David G. Parker. Oxyfunctionalization of hydrocarbons. 4. Fluorosulfuric acid-antimony pentafluoride, fluorosulfuric acid, sulfuric acid, and hydrofluoric acid induced electrophilic oxygenation of alkanes with hydrogen peroxide. „J. Am. Chem. Soc.”. 99 (2), s. 483–488, 1977. DOI: 10.1021/ja00444a027.
- ↑ J. Clayden, N. Greeves, S. Warren, P. Wothers: Organic Chemistry. Nowy Jork: Oxford University Press, 2007, s. 1258. ISBN 978-0-19-850346-0.
Media użyte na tej stronie
Kation Eigena
Resonance of a protonated or alkylated carbonyl group
Hydroxonium cation