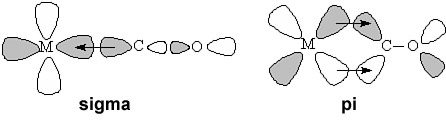Karbonylki
Karbonylki – nieorganiczne związki kompleksowe, w których ligandem jest tlenek węgla, stosowane w chemii metaloorganicznej. Nazwę karbonylek stosuje się także na określenie samego ligandu karbonylkowego, CO (nie należy mylić go z organiczną grupą karbonylową).
Pierwszy związek zawierający ligandy karbonylkowe został otrzymany przez Ludwiga Monda w 1888 r. Mond zauważył, że tlenek węgla reaguje z niklem tworząc związek o zadziwiająco niskiej temperaturze wrzenia (43 °C)[1], który po podgrzaniu do ok. 100 °C rozkłada się ponownie do niklu i tlenku węgla:
Mond zastosował proces syntezy, destylacji i rozkładu termicznego tetrakarbonylku niklu do otrzymywania bardzo czystego niklu w swojej hucie w Walii. Proces ten do dziś jest z powodzeniem stosowany przy produkcji tego metalu. Synteza karbonylków wielu innych metali jest równie prosta, choć czasem wymaga nieco drastyczniejszych warunków lub stosowania dodatkowych „tricków” syntetycznych.
Tlenek węgla posiada wolną parę elektronową na atomie węgla i jest w związku z tym słabą zasadą Lewisa. Słabe zasady Lewisa zwykle nie reagują z metalami na zerowym stopniu utlenienia. Jednak wiązanie M-CO jest stabilizowane przez szczególny układ orbitali molekularnych:
Wiązanie σ jest wiązaniem koordynacyjnym, w którym funkcję donora elektronów pełni karbonylek – samo w sobie jest ono jednak energetycznie niekorzystne i, jak dowodzą obliczenia kwantowo-mechaniczne, jest ono właściwie lekko antywiążące. Cały układ jest dopiero stabilizowany przez wiązania π między orbitalami sp tlenku węgla i orbitalami d metalu, przy czym rolę donora elektronów odgrywa tu metal, a nie karbonylek. (Jest to przykład tak zwanego „wiązania zwrotnego” inaczej „redonorowego”)
Wiązanie metal-karbonylek jest jednak względnie słabe. Ligand karbonylkowy można bardzo łatwo oderwać od metalu – dzięki czemu łatwo wymienia się go na inne ligandy (L'):
Dość łatwo można też wyeliminować jeden lub więcej ligandów karbonylkowych i otrzymać bardzo stabilne aniony o wysokiej zasadowości:
Z kolei aniony te są bardzo dobrymi odczynnikami nukleofilowymi, z których bardzo łatwo można otrzymać wodorki karbonylkowe:
które są kwasami protonowymi, o zróżnicowanej mocy (np.: HCo(CO)4 ma pKa=1), przy czym wodór jest w nich ligandem atomu centralnego i może zostać wymieniony na inny ligand, np.:
Labilne własności karbonylków metali połączone z łatwością ich syntezy powodują, że są one bardzo często podstawowym, wyjściowym substratem do otrzymywania wielu związków metaloorganicznych. Łatwość zrywania i tworzenia wiązań metal-karbonylek jest też bardzo przydatna w katalizie i dlatego ogromna większość katalizatorów metaloorganicznych zawiera zwykle przynajmniej jeden ligand tego rodzaju – kompleksy czysto karbonylkowe są jednak zbyt reaktywne aby same pełnić tę rolę. Jedyny wyjątek stanowi Fe2(CO)9, który był stosowany w latach 1925–1945 jako dodatek przeciwstukowy do benzyny w Niemczech i krajach okupowanych przez Niemcy w czasach II wojny światowej.
Napisane częściowo na podstawie: M.Bochmann, Organometallics 1, seria: Oxford Chemistry Primer, Oxford University Press, 1992.
Przypisy
- ↑ S Budavari, The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. Whitehouse Station, NJ: Merck and Co., Inc., 1996., p. 1117, 1996.