Kiła
| lues, syphilis | |
 Krętki blade | |
| ICD-10 | A50 |
|---|---|
| A50.0 | Kiła wrodzona wczesna objawowa |
| A50.1 | Kiła wrodzona wczesna utajona |
| A50.2 | Kiła wrodzona wczesna, nieokreślona |
| A50.3 | Kiłowa wrodzona późna okulopatia |
| A50.4 | Kiła późna układu nerwowego [kiła układu nerwowego wieku młodzieńczego] |
| A50.5 | Inne postacie kiły wrodzonej późnej objawowej |
| A50.6 | Kiła wrodzona późna utajona |
| A50.7 | Kiła wrodzona późna, nieokreślona |
| A50.9 | Kiła wrodzona, nieokreślona |
| ICD-10 | A51 |
| A51.0 | Kiła pierwotna w obrębie narządów płciowych |
| A51.1 | Kiła pierwotna w obrębie odbytu |
| A51.2 | Kiła pierwotna o innym umiejscowieniu |
| A51.3 | Kiła wtórna skóry i błon śluzowych |
| A51.4 | Inne postacie kiły wtórnej |
| A51.5 | Kiła wczesna utajona |
| A51.9 | Kiła wczesna, nieokreślona |
| ICD-10 | A52 |
| A52.0 | Kiła układu krążenia |
| A52.1 | Kiła objawowa układu nerwowego |
| A52.2 | Kiła bezobjawowa układu nerwowego |
| A52.3 | Kiła układu nerwowego, nieokreślona |
| A52.7 | Inne postacie kiły późnej objawowej |
| A52.8 | Kiła późna utajona |
| A52.9 | Kiła późna, nieokreślona |
| ICD-10 | A53 |
| MedlinePlus | |
| MeSH | |
Kiła (łac. lues, syphilis, stgr. σύφλος syphlos, „brudny”) – choroba przenoszona głównie drogą płciową, wywoływana przez krętka bladego (łac. Treponema pallidum ssp. pallidum). Do zakażenia może również dojść drogą przezłożyskową.
Kiłę można podejrzewać na podstawie wywiadu epidemiologicznego i badania fizykalnego, ale ostateczne rozpoznanie ustala się obecnie (XX/XXI wiek) na podstawie badań laboratoryjnych. Odpowiednio wcześnie wykryta może być skutecznie leczona za pomocą antybiotyków, jednak w skali makro równie ważne znaczenie w walce z tą chorobą ma nadzór epidemiologiczny i właściwa polityka zdrowotna państwa.
W 1998 opublikowano pełną sekwencję genetyczną Treponema pallidum, co może pomóc w zrozumieniu patogenezy kiły[1].
Historia

Pochodzenie tej choroby jest nieznane. Po raz pierwszy epidemia pojawiła się w Europie podczas wojny o Neapol[2] w 1494 i szybko rozprzestrzeniła się na inne kraje. Dlatego istnieje teoria, iż chorobę przywieziono do Barcelony po drugiej wyprawie Kolumba (1493–1494), podczas której mężczyźni masowo gwałcili kobiety indiańskie (choroba istniała w łagodnej formie w Ameryce przed przybyciem Kolumba).
Według kronikarza Marcina Bielskiego chorobę do Polski przywlokła w roku 1495 kobieta znana jako Wojciechowa, żona niejakiego Wojciecha Białego z Krakowa, która powróciła zakażona z odpustu w Rzymie. Krótko potem, prawdopodobnie w wyniku zachorowań na kiłę, zmarli królowie Polski: Jan I Olbracht (zm. 1501) i Aleksander Jagiellończyk (zm. 1506) oraz ich brat, prymas Polski i kardynał Fryderyk Jagiellończyk (zm. 1503)[3].
Istnieją jednak przypuszczenia na temat wcześniejszego występowania tej choroby w Europie, także na terenach dzisiejszej Polski. Przesłanką może być jedna z postaci w ołtarzu Wita Stwosza w Krakowie (1477–1489), wyrzeźbiona z charakterystycznym dla kiły nosem siodełkowatym[4].
Anonimowy autor Compendium medicum auctum... z 1719 roku dał wierszowany obraz tej choroby:
Venus zdradliwa roskosz cukruje,
Wkrótce nad kata ciało morduje
Uprzykszonemi, zbyt bolesnemi
Wrzody, guzami zaraźliwemi...
Usta wyrzuca y podniebienie,
Mowę odmienia jej zarażenie...
Rękom y nogom władzę odjęła,
Wszystkiego człeka w niewolę wzięła...
Zmięszała głowę, snu nie pozwoli,
Sumienie gryzie dla swojej woli.
O jak mizerna uciecha ciała,
Niejednemu się we znaki dała.
W Polsce kiłę leczono m.in. w Krakowie, gdzie chorych przyjmowano w Szpitalu św. Sebastiana i Rocha (powstał w 1528 roku w rejonie dzisiejszej ul. św. Sebastiana), za murami miasta. Leczenie polegało na wcieraniu szaruchy, później podawano także „odwary drzewne” z lignum Guajaci (nalewka gwajakowa). Inna metoda polegała na wkładaniu chorych do dobrze ogrzanego pieca, aby się wypocili po nacieraniu rtęcią. Kuracja trwała zwykle trzy miesiące, ale wielu cierpiących umierało przed jej zakończeniem. W XVII w. krakowski szpital „dla kiłowych” cieszył się dużą popularnością. Przebywali w nim pacjenci z Częstochowy, Warszawy i z Wielkopolski. Wśród chorych przeważały kobiety. Większość pensjonariuszy wywodziło się z ludu, ale zdarzały się też osoby ze stanu szlacheckiego[5].
Nazwy i ich pochodzenie
Kiła występowała dawniej pod wieloma różnymi nazwami: syfilis, choroba francuska (łac. morbus gallicus)[6] (w Rosji „choroba polska”, we Francji „choroba angielska”, w Polsce „choroba niemiecka”[6]), franca, choroba dworska, przydomek dworski, choroba sekretna, choroba hiszpańska, przymiot, pudendagra, pani franca, świerzba, dziki świerzb, syf, weneria, katar kanalicowy, ospa miłosna, niemoc kurewników i cudzołożników[7]. Nazwa choroby francuskiej, morbus gallicus, wywodzi się od wybuchu epidemii w armii francuskiej. Nazwa syphilis zostawała ukuta przez włoskiego lekarza i poetę Girolamo Fracastoro w jego epickim poemacie napisanym po łacinie, o tytule Syphilis sive morbus gallicus (łac. „Syfilis albo choroba francuska”) z 1530[8]. Protagonistą poematu był pasterz zwany Syfilusem (być może odpowiednik postaci z „Metamorfoz” Owidiusza, Sipylusa). Syfilus jest przedstawiony jako pierwszy człowiek, który zachorował na tę chorobę, zesłaną przez boga Apolla jako kara za nieposłuszeństwo, jakie okazał mu Syfilus i jego stronnicy. Poprzez dodanie przyrostka -is do tematu Syfilus Fracastoro utworzył nową nazwę choroby, która została także użyta w medycznym tekście De contagionibus („O chorobach zaraźliwych”)[9]. Do tego czasu, jak podaje Fracastoro, kiłę nazywano „chorobą francuską” we Włoszech i Niemczech, a „chorobą włoską” we Francji[10]. Dodatkowo, Holendrzy nazywali ją „chorobą hiszpańską”, Rosjanie „chorobą polską”, Turcy „chorobą chrześcijan”, a Tahitańczycy „chorobą brytyjską”[11]. Druga łacińska nazwa kiły lues pochodzi od łacińskiego czasownika luere – „pokutować”.
Badanie Tuskegee
Jednym z najbardziej bulwersujących i najlepiej udokumentowanych przypadków nieetycznych badań medycznych na ludziach w XX wieku było badanie Tuskegee. Odbyło się ono w Tuskegee w Alabamie i było wspierane przez Tuskegee Institute oraz United States Public Health Service (PHS)[12].
Badanie rozpoczęło się w 1932 i przeprowadzono je na grupie 600 czarnoskórych farmerów. Spośród nich 399 było chorych na kiłę, a 201 osób stanowiło niezakażoną grupę kontrolną. PHS oznajmiło na początku, że leczenie ma być częścią badania, jednakże nie uzyskano żadnej użytecznej wiedzy pod tym kątem. Później odkryto, że PHS zdecydowało się na pozostawienie mężczyzn bez leczenia i pozwolenie im dojść do terminalnego stadium choroby i ostatecznie zgonu. Farmerzy myśleli, że poddają się eksperymentalnej terapii na „złą krew” w zamian za darmowe posiłki, a ich rodziny otrzymają 50 dolarów w przypadku ich śmierci. W rzeczywistości badanie było nastawione na poznanie przebiegu nieleczonej kiły i określenie, czy choroba powoduje większe uszkodzenia w układzie nerwowym czy układzie krążenia, oraz ustalenie różnic w przebiegu choroby u białych i czarnych. W 1947 penicylina stała się standardem leczenia kiły, ale mężczyznom tym nigdy nie powiedziano, że chorują na kiłę, ani też nie zaproponowano leczenia, nawet salwarsanem lub innym lekiem zawierającym arsen, które były dostępne już na początku eksperymentu.
Zakładano początkowo, że badanie będzie trwać 6–9 miesięcy, lecz kontynuowano je przez 40 lat i zakończono w 1972, długo po tym, jak żony i dzieci zostały zakażone kiłą, a wielu mężczyzn umarło z powodu tej choroby. Oszacowano, że w wyniku eksperymentu zmarło ponad 100 osób. Badanie zakończono z powodu publikacji na ten temat w „Washington Star”. Rządowi wytoczono proces z powództwa cywilnego. Dokonano ugody poza procesem, w wyniku czego żyjący uczestnicy badania i ich potomkowie otrzymali 10 milionów dolarów odszkodowania. Po dokonaniu rekompensaty rząd wprowadził akt prawny National Research Act, na podstawie którego instytucje rządowe miały obowiązek obserwowania i zaaprobowania wszystkich badań medycznych z udziałem ludzi.
Zakażenie
Zakażenie kiłą jest wynikiem stosunku pochwowego, analnego lub oralnego z osobą zakażoną. Narażone są również osoby zdrowe przez pocałunek z osobą zakażoną, u której zmiany kiłowe są obecne w gardle. Każde uszkodzenie skóry u osoby zdrowej naraża ją na ryzyko podczas intymnego kontaktu z osobą zakażoną. Nieleczona kiła prowadzi do uszkodzenia układu nerwowego, utraty wzroku, zaburzeń psychicznych, uszkodzenia układu krążenia, kości, stawów i narządów miąższowych, a także w niektórych przypadkach może być przyczyną śmierci. Ponadto w przebiegu ciąży kobiety chorej na kiłę dochodzi do wewnątrzmacicznego zakażenia płodu bakteriami znajdującymi się we krwi matki. Może dojść do śmierci wewnątrzmacicznej płodu lub dziecko może urodzić się z poważnymi wadami rozwojowymi.
Krętki blade przedostają się przez wrota zakażenia i szybko się namnażają. Następnie dochodzi do rozsiewu bakterii drogami chłonnymi i poprzez krew. Zakażenie organizmu doprowadza do choroby ogólnoustrojowej. Miejscem obfitego rozwoju krętków są węzły chłonne i tkanki w pobliżu miejsca wtargnięcia. W węzłach chłonnych chorego drobnoustroje pojawiają się już w ciągu pierwszych 24 godzin, a w płynie mózgowo-rdzeniowym już w 3 tygodnie od momentu zakażenia. Zmiany związane z zakażeniem Treponema pallidum mogą dotyczyć każdego narządu, nie wyłączając ośrodkowego układu nerwowego.
Epidemiologia
brak danych
poniżej 35
35–70
70–105
105–140
140–175
175–210
210–245
245–280
280–315
315–350
350–500
ponad 500
Liczba zarejestrowanych przypadków zachorowań na kiłę nabytą w Polsce w 2005 roku wynosiła 613 ze współczynnikiem zapadalności 1,61[14]. Chorobowość w państwach Europy Wschodniej wynosi 5/100 000 osób/rok, a w Rosji 100-300/100 000 osób/rok, mężczyźni chorują 2 razy częściej. Od 2000 roku doszło do wzrostu zachorowań w Stanach Zjednoczonych, Europie, Australii, do czego w głównej mierze przyczynił się seks bez zabezpieczeń wśród mężczyzn mających kontakty seksualne z mężczyznami[15][16][17].
Podział
| Okres | Czas trwania | Odczyny kiłowe |
|---|---|---|
| Kiła wczesna (lues recens) | 2 lata | |
| 0. Okres inkubacji | 9–90 dni, średnio 21 | (-) lub (+) |
| 1. Kiła objawowa wczesna | ||
| 1.1. Kiła I okresu (lues primaria) | 3–9 tygodni | (-) lub (+) |
| 1.1.1. Kiła surowiczoujemna (lues seronegativa) | 3–6 tygodni | (-) lub (+) |
| 1.1.2. Kiła surowiczododatnia (lues seropositiva) | 6–9 tygodni | (+) |
| 1.2. Kiła II okresu (lues secundaria) | 9 tygodni-2 lata | (+) |
| 1.2.1. Kiła II okresu wczesna (lues secundaria recens) | 9–16 tygodni | (++) |
| 1.2.2. Kiła II okresu nawrotowa (lues secundaria recidivans) | 16 tygodni-2 lata | (++) |
| 2. Kiła wczesna utajona (lues latens recens) | * | (+) lub (++) |
| Kiła późna (lues tarda) | ||
| 1. Kiła utajona późna (lues latens tarda) | >2 lata ** | (+) lub (++) |
| 2. Kiła objawowa późna (lues symptomatica tarda) = kiła III okresu (lues tertiaria) | > 5 lat | (+) lub (++) |
* – Stan bezobjawowego zakażenia trwający 2 lata lub okresy bezobjawowe klinicznie po ustąpieniu zmian w kile I i II okresu.
** – Stan bezobjawowego zakażenia trwający ponad 2 lata, poprzedzający rozwój kiły późnej.
Kiła wczesna (lues recens)
Trwa do 2 lat od momentu zakażenia.
Kiła I-rzędowa (kiła pierwszego okresu)
- I – okres kiły pierwotnej z wytworzeniem objawu pierwotnego. Wyróżnia się w nim:
- kiłę surowiczoujemną – do 6 tygodnia
- kiłę surowiczododatnią – 6–9 tydzień
Krętek blady wnika do organizmu przez nienaruszoną błonę śluzową lub niewielkie uszkodzenia skóry. W ciągu kilku godzin powoduje uogólnioną bakteriemię. Pierwszym objawem choroby jest pojawienie się niebolesnej zmiany pierwotnej (affectio primaria), której często towarzyszy powiększenie okolicznych węzłów chłonnych. Pojawia się ona średnio około 3 tygodni od wniknięcia patogenu i utrzymuje się około 2 do 6 tygodni. Następnie goi się samoistnie w ciągu 3–4 tygodni. Typowa zmiana pierwotna powstaje jako bezbolesna grudka, która w krótkim czasie ulega owrzodzeniu, z charakterystycznym podminowaniem jej brzegów.
Daje jej to charakterystyczną konsystencję chrząstki i stąd nazwa wrzód twardy (łac. ulcus durum), inaczej wrzód Huntera (ulcus Hunteri), owrzodzenie pierwotne (sclerosis initialis). U mężczyzn zmiana pierwotna zlokalizowana jest na członku lub w kanale odbytu, odbytnicy, jamie ustnej[19]. U kobiet najczęstszym miejscem występowania owrzodzenia pierwotnego jest szyjka macicy i wargi sromowe. W związku z mniej widoczną lokalizacją zmian u kobiet i osób, które uległy zakażeniu przez odbyt, kiła pierwotna jest rzadziej u nich rozpoznawana[19]. W obecnych czasach zmiana pierwotna często ma nietypowy wygląd – wpływ na to ma powszechne stosowanie antybiotyków. Zmiana ta najczęściej wymaga różnicowania z zakażeniem wirusem opryszczki, z wrzodem miękkim oraz zakażonymi zmianami urazowymi. W ciągu tygodnia od pojawienia się owrzodzenia dołącza się powiększenie okolicznych węzłów chłonnych, które może utrzymywać się przez wiele miesięcy i jest zwykle obustronne. Węzły są twarde, niebolesne i nie wykazują tendencji do ropienia.
Nietypowy objaw pierwotny
Tylko 20% zmian ma postać typowego objawu pierwotnego, do innych postaci należą:
- mnogie objawy pierwotne
- postać współistniejąca z opryszczką
- objaw pierwotny opryszczkopodobny
- zapalenie kiłowe żołędzi (balanitis primaria syphilitica)
- kiłowe zapalenie sromu i pochwy (vulvovaginitis primaria syphilitica)
- postać poronna (objaw bardzo mały)
- postać olbrzymia (zmiana o średnicy powyżej 2 cm)
- postać o nietypowej lokalizacji (np. na palcu, odbycie, brodawce sutkowej, błonie śluzowej jamy ustnej)
- postać szczelinowata
- objaw pierwotny żrący
- postać zgorzelinowa
- dodatkowe zakażenie – stan zapalny, bolesność, obrzęk.
Powikłania kiły I-rzędowej
Kiła II-rzędowa
- II – okres kiły wtórnej z pojawieniem się charakterystycznej osutki kiłowej (skórnej – exanthema i błon śluzowych – enanthema). Wyróżnia się w nim:
- II-rzędową kiłę wczesną (lues recens) – 9–16 tydzień
- II-rzędową kiłę nawrotową (lues recidivans) – po 16 tygodniach
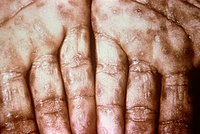
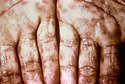
Niestałym objawem tego okresu kiły jest umiejscowiona lub uogólniona wysypka śluzowo-skórna lub bezbolesne uogólnione powiększenie węzłów chłonnych. U około 15% z objawami kiły drugorzędowej stwierdza się jeszcze obecność zmiany pierwotnej. Zmiany skórne mają charakter plamkowy (lues maculosa), grudkowy (lues papulosa), grudkowo-łuskowy lub rzadziej krostkowy (lues pustulosa). Wysypka może mieć bardzo niewielkie nasilenie, tak że u 25% chorych nie obserwuje się zmian dermatologicznych. Zmiany skórne mają początkowo wygląd blado-czerwonych lub różowych nieswędzących plamek o średnicy 5–10 milimetrów. Zlokalizowane są na tułowiu oraz bliższych odcinkach kończyn. Po kilku tygodniach pojawiają się także czerwone zmiany grudkowe, które mogą wystąpić na całym ciele, ale najczęściej pojawiają się na dłoniach i stopach oraz twarzy i owłosionej skórze głowy. Często ulegają martwicy, co nadaje im wygląd krost. W wilgotnych częściach ciała (okolice odbytu, sromu, worka mosznowego, wewnętrznej powierzchni ud, pod piersiami) grudki z czasem mogą się powiększać, ulegając powierzchownej erozji. Prowadzi to do powstania szarawo-białych, szerokich u podstawy i wilgotnej powierzchni zmian zwanych kłykcinami płaskimi (condylomata lata). Wydzielina tych zmian jest wysoce zakaźna.
Zmianom skórnym towarzyszą objawy ogólne, które mogą występować równolegle lub je wyprzedzać. Należą do nich: bóle gardła (5–30% chorych), gorączka (5–8%), utrata masy ciała (2–20%), złe samopoczucie (25%), utrata łaknienia (2–10%), ból głowy (10%), podrażnienie opon mózgowych (5%) lub ich zapalenie (1–2%). Brak leczenia w tym okresie doprowadza do powstania objawów kiły późnej, zwanej też trzeciorzędową lub też wystąpienie kiły utajonej.
Kiła utajona wczesna (lues latens recens)
Kiłą utajoną wczesną określa się:
- okres 2 lat od początku zakażenia, w którym nie obserwuje się objawów klinicznych lub
- okresy bezobjawowe kiły wczesnej występujące pomiędzy okresami objawowymi.
Kiła późna (lues tarda)
Rozpoczyna się po 2 latach od zakażenia.
Kiła utajona późna
Kiłę utajoną rozpoznajemy w przypadku stwierdzenia dodatnich wyników klasycznych testów reaginowych oraz swoistego testu przeciwkrętkowego, przy braku zmian w płynie mózgowo-rdzeniowym oraz braku innych objawów klinicznych kiły. Rozpoznanie to możemy podejrzewać w przypadku wystąpienia danych z wywiadu sugerujących przebycie kiły pierwszo- lub drugorzędowej, oraz u matek, które urodziły dziecko z kiłą wrodzoną. Rozróżniamy kiłę utajoną wczesną do okresu 1 roku po zakażeniu, oraz kiłę utajoną późną powyżej tego okresu.
W okresie kiły utajonej możliwe jest zarażenie płodu, opisywano też przypadki zakażenia w wyniku transfuzji krwi. W przeszłości uważano, że kiła utajona może ulec samoistnemu wyleczeniu, obecnie uważa się, że krętki jednak pozostają w organizmie. U około 70% pacjentów z nieleczoną kiłą utajoną nigdy nie dochodzi do wystąpienia objawów kiły późnej.
Kiła III-rzędowa – kiła objawowa
III okres kiły późnej występujący po kilku latach od zakażenia. Przebieg w tym okresie często jest utajony, a na skórze występują zmiany guzkowate (kilaki).
Kiła późna
W zależności od głównej lokalizacji procesu chorobowego rozróżnia się następujące postaci:
- bezobjawowa kiła układu nerwowego (lues nervosa asymptomatica)
- objawowa kiła układu nerwowego
- kiła układu krążenia (lues cardiovascularis)
- łagodna kiła trzeciorzędowa (kilaki, gummata).
Bezobjawowa kiła układu nerwowego
Do zakażenia układu nerwowego dochodzi we wczesnych okresach choroby, zwykle w ciągu pierwszych tygodni od zakażenia. Rozpoznanie tej postaci kiły stawia się u ludzi, u których nie stwierdzono już objawów kiły pierwszorzędowej ani drugorzędowej, bez żadnych objawów neurologicznych, u których stwierdza się jednak zmiany obrazu płynu mózgowo-rdzeniowego.
Objawowa kiła układu nerwowego
Może przybierać trzy główne postacie kliniczne: kiły oponowej, oponowo-naczyniowej, i kiły mózgowej (miąższowej). Wyróżnienie tych postaci jest jednak trudne, ze względu na częste występowanie postaci mieszanych. Okresy pomiędzy zakażeniem a wystąpieniem objawów w przypadku kiły układu nerwowego przedstawia się następująco:
- kilka miesięcy do 1 roku – kiła oponowa przebiegająca w postaci ostrego kiłowego zapalenia opon mózgowych (meningitis luetica acuta)
- średnio około 7 lat – kiła oponowo-naczyniowa mózgu i rdzenia (lues meningovascularis cerebri et medullae spinalis)
- średnio około 20 lat – porażenie postępujące (paralysis progressiva)
- średnio około 25 lat – wiąd rdzenia (tabes dorsalis).
Kiła oponowa może dotyczyć zarówno mózgu, jak i rdzenia kręgowego. Pierwszymi obserwowanymi objawami są bóle głowy, nudności, wymioty, sztywność karku, porażenia nerwów czaszkowych, drgawki, zaburzenia psychiczne.
W przebiegu kiły oponowo-naczyniowej dochodzi dodatkowo do rozlanego zapalenia naczyń, w przebiegu którego pojawiają się objawy ogniskowe, z najbardziej charakterystycznym dla kiły udarem w obszarze tętnicy środkowej mózgu u osoby w młodym wieku. Objawami kiły miąższowej, która występuje w przypadku rozsianego uszkodzenia mózgu są zmiany osobowości, zaburzenia nastroju i intelektu, upośledzenie pamięci krótkotrwałej, zaburzenia mowy, orientacji oraz omamy i urojenia.
Z charakterystycznych objawów neurologicznych należy wymienić objaw Argylla Robertsona polegający na występowaniu wąskiej, nieregularnej źrenicy o zachowanej reakcji na akomodację i braku reakcji na światło.
Celem potwierdzenia wystąpienia kiły układu nerwowego konieczne jest wykonanie nakłucia lędźwiowego i pobranie płynu mózgowo-rdzeniowego do dalszej diagnostyki. Wyniki tego badania wpływają na sposób, jak i długość leczenia infekcji. Badanie to wykonuje się także u osób, u których nie obserwuje się objawów kiły układu nerwowego w przypadkach kiedy trudno zdefiniować moment zakażenia i (lub) występują objawy charakterystyczne dla kiły drugorzędowej, a przede wszystkim kiedy w wynikach badań krwi VDRL > 32, a TPHA jest silnie dodatnie. Świadczyć to może o masywnym zakażeniu Treponema pallidum co sugeruje (biorąc pod uwagę silny tropizm drobnoustroju do układu nerwowego) możliwość zajęcia OUN. Jednakże jeśli do momentu rozpoczęcia leczenia nie wystąpiły objawy ze strony OUN można powstrzymać chorobę przed rozwojem oraz z powodzeniem ją wyleczyć. Cofnięcie zmian powstałych w strukturach naczyniowych, jak i miąższowych mózgu jest już jednak raczej niemożliwe. Dlatego tak istotne jest w miarę sprawne wdrożenie leczenia poparte pełną diagnostyką.
Kiła układu krążenia
Objawy ze strony układu krążenia w przebiegu kiły związane są z zajęciem vasa vasorum, naczyń odżywiających ściany dużych tętnic.
W wyniku tego procesu dochodzi do martwicy błony środkowej tętnicy i rozpadu tkanki elastycznej ściany tętnicy. Predysponowane do tego są zwłaszcza okolice aorty wstępującej, rzadziej łuku aorty (nigdy nie pojawia się na aorcie brzusznej)[20], co daje obraz kiłowego zapalenia aorty, zwężenia ujść tętnic wieńcowych, niedomykalności aortalnej lub powstania tętniaka łuku aorty. Kiłowe zapalenie aorty może dawać objaw de Musseta[21].
W każdym okresie kiły może wystąpić zarostowe zapalenie tętnic mózgu (endarteritis obliterans).
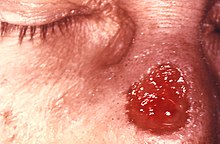
Łagodna kiła trzeciorzędowa (kilak)
Kilaki mogą występować jako zmiany gromadne i dotyczyć wielu narządów, jednakże najczęściej są zmianami pojedynczymi o wymiarach od kilku milimetrów do kilku centymetrów. Najczęściej dotyczą układu skóry i układu szkieletowego, śluzówek jamy ustnej i górnych dróg oddechowych, żołądka i wątroby. Mogą jednak występować w każdym innym miejscu organizmu. W obrębie skóry przyjmują wygląd zmian guzowatych, układających się w charakterystyczne kręgi lub łuki z ogniskami hiperpigmetacji na obwodzie. Należy je różnicować ze zmianami skórnymi w przebiegu chorób ziarniakowych, takich jak gruźlica, trąd i sarkoidoza. W obrębie układu szkieletowego najczęściej dotyczą kości długich.
Kiła wrodzona
| Lues congenita | |
 | |
| ICD-10 | |
|---|---|
| A50.0 | Kiła wrodzona wczesna objawowa |
| A50.1 | Kiła wrodzona wczesna utajona |
| A50.2 | Kiła wrodzona wczesna, nie określona |
| A50.3 | Kiłowa wrodzona późna okulopatia |
| A50.4 | Kiła późna układu nerwowego [kiła układu nerwowego wieku młodzieńczego] |
| A50.5 | Inne postacie kiły wrodzonej późnej objawowej |
| A50.6 | Kiła wrodzona późna utajona |
| A50.7 | Kiła wrodzona późna, nie określona |
| A50.9 | Kiła wrodzona, nie określona |
Wyróżnia się kiłę wrodzoną, gdy do zakażenia dochodzi w życiu płodowym od chorej matki (po 5 miesiącu od zapłodnienia, gdy bariera łożyskowa ulega osłabieniu i gdy już istnieje posocznica w ciele matki – czyli 2–3 lata od zakażenia). Niekiedy w tych przypadkach kiła prowadzi do śmierci płodu i poronienia lub urodzenia martwego płodu. W przypadku żywych urodzeń możemy mieć do czynienia z kiłą wrodzoną wczesną (lues congenita recens) i późną (lues congenita tarda). W kile wczesnej występują następujące objawy:
- nos siodełkowaty (nasus sellatus) – w wyniku uszkodzenia części kostnych (lemiesza i kości nosowych)
- zapalenie kostno-chrzęstne (osteochondritis)
- zajady (rhagades) – linijne pęknięcia w kącikach ust
- sapka (coryza)
- plamki kiłowe (lues maculosa)
- grudki kiłowe (lues papulosa)
- pęcherze kiłowe (lues pemphigosa)
- osutka kiłowa (exanthema)
- marskość wątroby
- kilaki prosowate (gummata miliaria)
- w grasicy ropień Dubois (abscessus Dubois)
- zapalenie białe płuc (pneumonia alba)
- wytwórcze zapalenie śródmiąższowe w różnych narządach (nerki, serce, nadnercza, trzustka, śledziona).
Dla kiły późnej charakterystyczne są takie objawy jak:
- triada Hutchinsona (zęby Hutchinsona, głuchota błędnikowa (surditas), zapalenie miąższowe rogówki (keratitis parenhymatosa) prowadzące do bielma (leukoma))
- szablaste podudzia
- czoło olimpijskie[22]
- nos siodełkowaty (zniszczenie części chrzęstnej i kostnej nosa)[22]
- nos lornetkowaty (zmiany destrukcyjne przegrody nosa)[22]
- kiłowe zapalenie okostnej (periostitis luetica)
- kiłowe przewlekłe zapalenie opon miękkich (neurosyphilis meningovascularis)
- zanik nerwu II
- uszkodzenie nerwu VIII
- pogrubienie nasad przymostkowych obojczyka (objaw Higoumenakisa)
- blizny Parrota (cicatrices Parroti) wokół ust i odbytu.
Diagnostyka
W wyniku zakażenia krętkiem bladym dochodzi do powstania przeciwciał skierowanych przeciw antygenom tej bakterii (antygenowi wielocukrowemu, antygenom białkowym, czy też antygenom lipidowowym np. kardiolipinie).
Przeciwciała te można podzielić na dwa typy:
- skierowane przeciwko lipidowym składnikom bakterii tzw. przeciwciała reaginowe
- przeciwciała swoiście przeciw Treponema pallidum.
Pierwszy typ reakcji powstaje również w przebiegu innych zakażeń krętkami, fałszywie dodatni może być też w wielu innych chorobach, zwłaszcza autoimmunologicznych.
Wykonywane w praktyce testy nieswoiste (reaginowe) to
- VDRL – mikroskopowy test kłaczkowania (Veneral Disease Research Laboratory)
- USR – makroskopowy test kłaczkowania z nieogrzewaną surowicą (Unheated Serum Reagin).
Natomiast najczęstszymi testami swoistymi z antygenami krętków są:
- FTA-ABS – test immunofluoroscencji krętków w modyfikacji absorpcyjnej (Fluoroscent Treponemal Antibody Absorbent Test)
- TPHA – test hemaglutynacji (Treponema Pallidum Hemagglutination Assay).
Zastosowanie powyższych testów ma 3 główne implikacje kliniczne:
- badania przesiewowe przeprowadza się z użyciem badań VDRL lub USR
- ilościową ocenę miana przeciwciał reaginowych do oszacowania aktywności choroby lub monitorowanie odpowiedzi na leczenie przeprowadza się z użyciem badania VDRL
- potwierdzenie rozpoznania kiły u chorych z dodatnim wynikiem testu reaginowego, u którego występują bądź nie pojawiają się typowe objawy choroby przeprowadza się za pomocą badań FTA-ABS lub TPHA
Profilaktyka
- higiena osobista i unikanie przypadkowych kontaktów płciowych
- badania kobiet w ciąży
- prezerwatywa zmniejsza prawdopodobieństwo, ale nie zapobiega zakażeniu
Abstynencja od aktywności seksualnej jest bardzo efektywna w zapobieganiu zakażenia kiłą, chociaż należy zaznaczyć, że T. pallidum łatwo przechodzi przez nienaruszone śluzówki oraz uszkodzoną skórę. Wszyscy chorzy na kiłę powinni być przebadani na HIV. Osoby narażone poprzez kontakty seksualne z chorym na pierwszo-, drugorzędową lub wczesną utajoną kiłę w ciągu 90 dni przed postawieniem rozpoznania powinny być leczone, nawet jeśli aktualnie są seronegatywne. Jeśli ekspozycja nastąpiła wcześniej niż 90 dni względem momentu rozpoznania, leczenie zapobiegawcze jest wskazane, gdy badania serologiczne nie są dostępne natychmiast lub wynik badania jest niepewny.
Leczenie
W leczeniu stosuje się antybiotyki – najczęściej, najstarszy z nich – penicylinę w postaci penicyliny G[23] – drogą domięśniową lub dożylną. Dawkowanie i długość leczenia zależy od stadium choroby. Po zakończeniu kuracji chorzy podlegają badaniom kontrolnym, łącznie z badaniami serologicznymi, w celu potwierdzenia skuteczności leczenia. Warto zaznaczyć, że dodatnie odczyny serologiczne mogą utrzymywać się przez długi czas po zakończeniu terapii – w przypadku stosowania penicylin (ew. innych antybiotyków) o krótkim czasie działania za datę pełnego wyleczenia uznaje się podanie ostatniej dawki leku. W przypadku leków o przedłużonym działaniu (penicylina benzatynowa) czas ten może się przedłużyć do 14 dni od przyjęcia ostatniej dawki, zwykle jest to jednak tydzień. W kile wczesnej zwykle VDRL negatywizuje się wraz z upływem czasu (do ok. 12 miesięcy po wyleczeniu), w kile nawrotowej może pozostawać słabo dodatni nawet do końca życia, co nie oznacza, że pacjent jest chory – związane jest to z tzw. zjawiskiem surowiczooporności. Przy odpowiedniej terapii możliwe jest wyleczenie kiły we wszystkich stadiach choroby, chociaż cofnięcie zmian już spowodowanych przez nią (w późnych stadiach) nie jest już możliwe lub jest bardzo trudne (np. udar mózgu w przebiegu kiły). Co do zasad leczenia: W przypadku uczulenia można stosować tetracykliny – jednakże kiedy choroba jest dość rozwinięta (kiła układu nerwowego, kiła trzeciorzędowa) lub chce się uzyskać blisko stuprocentową gwarancję wyleczenia można przeprowadzić odczulanie na penicyliny – wykazujące dość wysoką skuteczność i poprawiające rokowanie poprzez możliwość wdrożenia najskuteczniejszego leku – penicyliny. Pomimo jej prymatu penicylina podawana doustnie nie wykazuje skuteczności w leczeniu infekcji kiłą[24]. Inne antybiotyki stosowane w leczeniu kiły to: doksycyklina, erytromycyna, azytromycyna i ceftriakson[25]. Potwierdzone są jednak przypadki, w których (być może ze względu na nieutrzymywanie reżimu przyjmowania leku przez pacjenta) leczenie to okazuje się nieskuteczne[26], należy też podkreślić, że w kile przebiegającej z możliwością zajęcia układu nerwowego – kiła drugorzędowa z wysokimi odczynami serologicznymi, kiła późna, kiła trzeciorzędowa – złotym standardem jest hospitalizacja pacjenta i diagnostyka płynu mózgowo – rdzeniowego. Jeśli badanie potwierdzi penetrację do układu nerwowego manifestującą się w analizie diagnostycznej płynu mózgowo-rdzeniowego, leczenie jest dostosowywane do stanu chorego. Należy nadmienić, że pacjenci zakażeni jednocześnie wirusem HIV we wczesnym etapie kiły leczeni są jak pacjenci HIV seronegatywni, u których choroba przebiega z zajęciem OUN. Jeśli pacjenci ci znajdują się w późniejszych stadiach choroby ich leczenie jest kwestią podlegającą indywidualnym zaleceniom, jak i pogłębionej diagnostyce. Schematy leczenia kiły mogą się od siebie różnić i są zależne od polityki epidemiologicznej poszczególnych państw. Amerykańskie standardy kładą nacisk na leczenie jednorazową dawką penicyliny benzatynowej jeśli zakażenie mieści się w obrębie kiły pierwszo- bądź drugorzędowej. Te same standardy zakładają, że u pacjentów z HIV stosowanie dodatkowych dawek penicyliny może nie przynieść większej korzyści, te same źródła podkreślają jednak, że do potwierdzenia tego założenia brakować może dokładnych danych medycznych[27]. Polskie standardy podchodzą z rezerwą do stosowania penicyliny benzatynowej i dają pierwszeństwo leczeniu penicyliną prokainową i krystaliczną. Wynika to prawdopodobnie z faktu, iż: farmakokinetyka, a w szczególności spadek stężenia w organizmie penicyliny benzatynowej mogą wpływać na skuteczność eliminacji czynnika zakaźnego. Penicylinę benzatynową podaje się bowiem w odstępach tygodniowych – najczęściej trzy dawki – zawsze domięśniowo. W przerwie pomiędzy poszczególnymi dawkami jej skuteczność spada. Podawanie penicyliny prokainowej wiąże się z codziennymi wizytami w gabinecie zabiegowym przez okres od 14 do 20 dni. Jednakże ta metoda pozwala na utrzymanie względnie wysokiego poziomu substancji aktywnej, a tym samym jej silne działanie przez większość doby co może mieć znaczenie kliniczne – szczególnie u osób z osłabioną odpornością lub HIV. Łączne podawanie penicyliny prokainowej i probenecydu może znacznie wpływać na utrzymywanie się wysokich stężeń substancji terapeutycznej w organizmie pacjenta, gdyż probenecyd hamuje wydalanie penicyliny z moczem (działanie ujemnie sekrecyjne probenecydu) i tym samym zwiększa jej skuteczność co może istotnie wpływać na efektywność leczenia. W przypadkach kiedy odczyny serologiczne sugerują dość masywną infekcję lub (i) pacjent jest w drugim bądź trzecim stadium choroby zachodzi podejrzenie zajęcia OUN przez krętka bladego – do zajęcia może zajść na każdym etapie rozwoju infekcji. Jeśli badanie płynu mózgowo-rdzeniowego potwierdzi penetracje do OUN schemat leczenia ulega zintensyfikowaniu – pacjent z reguły powinien być hospitalizowany przez okres ok. 11 dni w ciągu których przyjmować powinien 4 wlewy dożylne penicyliny krystalicznej na dobę. Po zakończeniu pobytu w szpitalu zalecane jest podawanie penicyliny prokainowej w warunkach ambulatoryjnych raz na dobę przez ok. 20 dni. Stosowanie terapii doustnymi antybiotykami jako terapii zastępującej leczenie penicyliną prokainową jest wysoce dyskusyjne i nie jest leczeniem z wyboru, głównie ze względu na ryzyko nawrotu choroby. Leczenie kiły według ustawy (Ustawa z zapobieganiu i zwalczaniu chorób zakaźnych, Art.40)[28] nakłada obowiązek całkowicie bezpłatnego leczenia pacjenta – bez względu na to czy jest ubezpieczony. Oznacza to, że diagnostyka, ew. leczenie szpitalne i pozaszpitalne bezpośrednio związane z zakażeniem kiłą jest nieodpłatne. W konsekwencji pacjent otrzymać powinien antybiotyki za darmo przez cały okres leczenia. W razie naruszenia tego przepisu pacjent powinien powiadomić Wojewódzką Stację Sanitarno – Epidemiologiczną.
W trakcie leczenia antybiotykami można spotkać się z następującymi powikłaniami:
- odczyn Łukasiewicza-Herxheimera-Jarischa – występuje szybki rozpad krętków po pierwszej iniekcji penicyliny, co wywołuje objawy ogólne, najczęściej podwyższenie temperatury ciała do 40 stopni Celsjusza. Zaleca się przed podjęciem i w trakcie leczenia przyjmowanie dużej ilości płynów. Nie jest przeciwwskazaniem do stosowania penicyliny. Jest częstszy w pierwszych etapach choroby, co przy ujemnej serologii płynu mózgowo – rdzeniowego jest objawem pozytywnym (poniekąd potwierdza wczesny etap choroby sugerując, iż nie doszło do zajęcia OUN). Nie stanowi zagrożenia dla zdrowia ani życia, jest raczej nieprzyjemnym doświadczeniem związanym z wydzielaniem toksyn krętkowych po rozpadzie. Może częściej występować u pacjentów zakażonych HIV i u osób, którym jednocześnie z penicyliną podaje się probenecyd[29].
- odczyn Hoigné – niezwykle rzadki powodujący głównie obawy natury psychicznej, szybko przemijający, nie pozostawiający śladu w organizmie.
- wstrząs anafilaktyczny – każdy pacjent – hospitalizowany czy nie – przy leczeniu penicyliną każdego rodzaju przechodzi dokładną próbę uczuleniową, która ma zapewnić bezpieczeństwo leczenia tymi preparatami. Wstrząs anafilaktyczny przez to należy do skrajnych powikłań stosowania penicyliny[24].
Choroby spowodowane przez inne gatunki Treponema
Choroby wywoływane przez inne gatunki lub podgatunki Treponema to:
- pinta – wywoływana przez Treponema carateum
- malinica – tropikalna choroba charakteryzująca się zakażeniem skóry, kości i stawów, wywoływana przez bakterię Treponema pallidum ssp. pertenue, nazywaną także Treponema pertenue
- kiła endemiczna – wywoływana przez Treponema endemicum
Zobacz też
Przypisy
- ↑ Fraser CM, Norris SJ, Weinstock GM, White O, Sutton GG, et al. Complete genome sequence of Treponema pallidum, the syphilis spirochete. „Science.”. 281 (5375), s. 375–388, 17 lipca 1998. DOI: 10.1126/science.281.5375.375.
- ↑ Oriel, JD: The Scars of Venus: A History of Venereology. London: Springer-Verlag, 1994.
- ↑ Michał Rożek Historia Krakowa. Choroba zwana francą, Dziennik Polski, 22 września 2012
- ↑ Franciszek Walter: Wit Stwosz – rzeźbiarz chorób skórnych, szczegóły dermatologiczne Ołtarza Mariackiego. Kraków: Krakowskie Towarzystwo Miłośników Historii Medycyny, 1933.
- ↑ Marek Żukow-Karczewski, Jak w Krakowie chorowano, „Gazeta Krakowska”, 4 VI 1993 r., nr 127 (13739).
- ↑ a b Andrzej Steciwko, Dominika Siejka: Choroby, które zmieniły bieg historii. Przewodnik Lekarza. [dostęp 2010-07-11]. (pol.).
- ↑ Kiła (LUES). [dostęp 2010-07-11]. (pol.).
- ↑ Eatough G: Fracastoro’s Syphilis. Liverpool: Francis Cairns, 1984.
- ↑ Girolamo Fracastoro: De Contagionibus. Wenecja: 1584, s. 106.
- ↑ Girolamo Fracastoro: De Contagionibus. Wenecja: 1584, s. 91.
- ↑ The Chinese disease? Syphilis is spreading fast in China. That raises wider concerns. „The Economist”, 13 stycznia 2007. The Economist Newspaper Limited 2007. [dostęp 2007-01-14].
- ↑ Tuskegee Syphilis Study. Encyclopedia Britannica. [dostęp 2010-07-11]. (ang.).
- ↑ WHO Disease and injury country estimates. [dostęp 2010-02-07].
- ↑ Narodowy Instytut Zdrowia Publicznego – Państwowy Zakład Higieny. pzh.gov.pl. [zarchiwizowane z tego adresu (2007-09-28)]..
- ↑ R.N. Fiddler, K.M. Gentilcore. Filter paper as a source of error in the determination of nitrite in meat. „J Assoc Off Anal Chem”. 58 (5), s. 1069–1070, Sep 1975. PMID: 1158826.
- ↑ C.K. Fairley, J.S. Hocking, N. Medland. Syphilis: back on the rise, but not unstoppable. „Med J Aust”. 183 (4), s. 172–173, Aug 2005. PMID: 16097910.
- ↑ Primary and Secondary Syphilis --- United States, 2003--2004. [dostęp 2010-02-07].
- ↑ Mroczkowski, Tomasz F: Choroby przenoszone drogą płciową. Wyd. Wyd. II poprawione. Lublin: Wydawnictwo Czelej, 2006. ISBN 83-89309-82-3.
- ↑ a b 162. Syphilis. W: Harrison’s principles of internal medicine. New York [etc.]: McGraw-Hill Medical, 2008. ISBN 978-0-07-146633-2.
- ↑ Jerzy Stachura, Wenancjusz Domagała: Patologia znaczy słowo o chorobie. Kraków: Wydawnictwo PAU, 2003, s. 267. ISBN 83-88857-65-7.
- ↑ Sapira JD., Quincke HI., de Musset A., Duroziez P., Hill LE. Quincke, de Musset, Duroziez, and Hill: some aortic regurgitations. „Southern medical journal”. 4 (74), s. 459–467, kwiecień 1981. PMID: 7013091.
- ↑ a b c „Choroby skóry” – S. Jabłońska, wyd. I.
- ↑ Centers for Disease Control. Sexually Transmitted Diseases Treatment Guidelines, 2006. „MMWR”. RR-11 (55), s. 24–32, 2006-04-08.
- ↑ a b Leczenie chorób przenoszonych drogą płciową. Część I: Choroby objawiające się owrzodzeniami narządów płciowych. Aktualne (2006 r.) wytyczne Centers for Disease Control and Pre...
- ↑ WHO Guidelines for the Management of Sexually Transmited Infections.
- ↑ Kiła układu nerwowego jako trudny problem w codziennej praktyce klinicznej – opis przypadku, www.termedia.pl [dostęp 2020-07-09] (pol.).
- ↑ CDC – Diseases Characterized by Genital, Anal, or Perianal Ulcers – 2010 STD Treatment Guidelines
- ↑ Postępowanie w przypadku podejrzenia lub rozpoznania zakażenia lub choroby zakaźnej oraz w przypadku stwierdzenia zgonu z powodu choroby zakaźnej - Ustawa o zapobieganiu oraz ..., legeo.pl [dostęp 2021-06-23] [zarchiwizowane z adresu 2016-03-04] (pol.).
- ↑ Rolfs RT., Joesoef MR., Hendershot EF., Rompalo AM., Augenbraun MH., Chiu M., Bolan G., Johnson SC., French P., Steen E., Radolf JD., Larsen S. A randomized trial of enhanced therapy for early syphilis in patients with and without human immunodeficiency virus infection. The Syphilis and HIV Study Group. „The New England journal of medicine”. 5 (337), s. 307–314, lipiec 1997. PMID: 9235493.
Bibliografia
- Behrman RE: Podręcznik pediatrii Nelsona. Warszawa: PWN, 1996, s. 883–887.
- Chechowski J. Wczesna postać kiły wrodzonej – omówienie na przykładzie przypadku. „Postępy Neonatologii”. Suplement II, s. 231–234, 2002. Poznań.
- Stefania Jabłońska, Sławomir Majewski: Choroby skóry i choroby przenoszone drogą płciową. PZWL, 2005. ISBN 83-200-3367-5.
- Lipska E, Konarska Z. Kiła wrodzona. „Nowa Pediatria”. 5, s. 45–49, 1999.
- Lauterbach R: Zakażenia u noworodka – wybrane zagadnienia. Forum – intensywna terapia noworodka. Bielsko-Biała: Alfa medica press, 2000, s. 96–97.
- Miedziński, Franciszek: Choroby skóry i weneryczne. PZWL, 1985. ISBN 83-200-0849-2.
- Mroczkowski, Tomasz F: Choroby przenoszone drogą płciową. Wyd. Wyd. II poprawione. Lublin: Wydawnictwo Czelej, 2006. ISBN 83-89309-82-3.
- Słomko Z, Drews K: Zakażenia perinatalne. Poznań: Polskie Towarzystwo Medycyny Perinatalnej, 2001, s. (materiały zjazdowe).
- Andrzej Stapiński: Zwalczanie kiły i rzeżączki w Polsce. Warszawa: PZWL, 1979.
- Medycyna wewnętrzna. Repetytorium dla studentów medycyny i lekarzy. Gerd Herold (red.). Warszawa: Wydawnictwo Lekarskie PZWL, 2006. ISBN 83-200-3380-2.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Oryginalnym przesyłającym był Pygmalion z niemieckiej Wikipedii, Licencja: CC-BY-SA-3.0
Harter Schanker (Ulcus durum) an der Penisunterseite
(c) Lokal_Profil, CC BY-SA 2.5
Age-standardised disability-adjusted life year (DALY) rates from Syphilis by country (per 100,000 inhabitants).
Krętki blade.
This patient presented with a gumma of nose due to a long standing tertiary syphilitic Treponema pallidum infection. Without treatment, an infected person still has syphilis even though there are no signs or symptoms. It remains in the body, and it may begin to damage the internal organs, including the brain, nerves, eyes, heart, blood vessels, liver, bones, and joints.
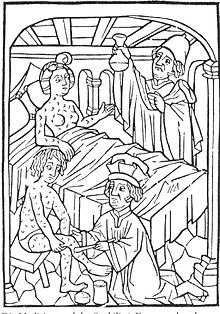
Syphilis treatment: Urine examination and treatment with ointments (mercury), Vienna 1498
Autor: Kauczuk, Licencja: CC BY-SA 4.0
Preparat "gummata hepatis" z wystawy w korytarzu budynku Collegium Medicum Uniwersytetu Jagiellońskiego na Grzegórzeckiej 16 w Krakowie.
Autor: Riksarkivet (National Archives of Norway) from Oslo, Norway, Licencja: No restrictions
Blida? – Infirmerie Bigot ( 1er tirailleurs Algériens) traitement de la Syphilis par injections bi- iodure.
Sykepleier vaksinerer mot syfilis.
Arkivref.: RAFA-5032_U1_6-1.Demyelinization of the posterior columns of the spinal cord known as "Tabes Dorsalis", or Tabetic Neurosyphilis. This image shows severe demyelinization of the posterior columns of the spinal cord due to long-standing syphilis disease. This can result in a staggering, wide-based gait, postural instability, pain and paresthesias; Myelin stain; magnification 450X.
A photograph of Hutchinson's teeth resulting from congenital syphilis. Hutchinson’s teeth is a congenital anomaly in which the permanent incisor teeth are narrow and notched. Note the notched edges and "screwdriver" shape of the central incisors. Copyright Restrictions: None - This image is in the public domain and thus free of any copyright restrictions. As a matter of courtesy we request that the content provider be credited and notified in any public or private usage of this image.
This patient presented with a case of secondary syphilis manifested as perinal wart-like growths.
- This patient with secondary syphilis manifested perineal condylomata lata lesions, which presented as gray, raised papules that sometimes appear on the vulva or near the anus, or in any other warm intertriginous region.
This photograph shows a close-up view of keratotic lesions on the palms of this patient’s hands due to a secondary syphilitic infection. Syphilis is a complex sexually transmitted disease (STD) caused by the bacterium Treponema pallidum. It has often been called "the great imitator" because so many of the signs and symptoms are indistinguishable from those of other diseases.
Bust of a patient with tertiary (gummatous) syphilis. The plaque reads "Syphilis tertiare. No. 11808. Coll. Dumoutier no. 306". Museé de l'Homme, Trocadéro, Paris.
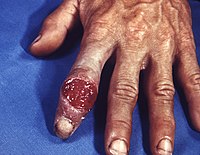
ID#: 4147 Description: This patient presented with an extragenital syphilitic chancre of the left index finger.
The chancre is usually firm, round, small, and painless, appearing at the spot where syphilis entered the body, and lasts 3-6 weeks, healing on its own. If adequate treatment is not administered, the infection progresses to the secondary stage. Content Providers(s): CDC Creation Date: 1969
Copyright Restrictions: None - This image is in the public domain and thus free of any copyright restrictions. As a matter of courtesy we request that the content provider be credited and notified in any public or private usage of this image.Examination, Tuskeegee study